Amphetaminmedikamente (AMP) bei ADHS
In den USA sind Amphetamin-Medikamente erhältlich als:1
- Mischung aus D- und L-Amphetamin-Isomeren (racemisches Gemisch)
- gemischte Sulfate und Saccharinate von D-L-Amphetamin-Isomeren (Adderall)
- reines D-Amphetaminsulfat
- Dexamfetaminhemisulfat (Attentin)
- D-Amphetamin als Lisdexamfetamin in lysingebundener Form (Elvanse, Vyvanse, Tyvense)
- racemisches Methamphetaminsulfat (Desoxyn, USA)
In Deutschland mussten Amphetaminmedikamente lange aus Rohsubstanzen durch Apotheker hergestellt werden.2 Seit 2011 ist ein D-Amphetamin in Deutschland als Fertigmedikament erhältlich und für die Behandlung von ADHS zugelassen (Attentin), 2013 wurde ein D-Amphetamin-Prodrug für die Behandlung von Kindern zugelassen. Lisdexamfetamin enthält D-Amp in lysingebundener Form (Elvanse). Seit Mai 2019 ist Elvanse Adult zur Behandlung von ADHS bei Erwachsenen zugelassen (30, 50, 70 mg). In 2023 wurden auch 20, 40, 60 mg für Erwachsene zugelassen. Seit März 2024 sind Elvanse und Elvanse adult zum Medikament Elvanse zusammengefasst und in 20, 30, 40, 50, 60 und 70 mg in Deutschland erhältlich.3 Seit März 2024 ist Elvanse bei Erwachsenen laut Fachinformation Takeda auch als Erstbehandlungsmittel indiziert, bei Kindern dagegen weiterhin erst, wenn MPH unzureichend wirkte.4
In Österreich kann Elvanse verschrieben werden, wenn andere Medikamente unwirksam sind oder Nebenwirkungen zeigen. Dies muss der Arzt gegenüber der Kasse begründen.
Amphetaminmedikamente wirken bei Erwachsenen etwas besser als Methylphenidat5 und zeigen etwas geringere Nebenwirkungen.
Amphetaminmedikamente sind nach dem aktuellen europäischen Konsensus aus Behandlungssicht das ADHS-Mittel erster Wahl bei Erwachsenen (vor Methylphenidat), und bei Kindern und Jugendlichen das Mittel zweiter Wahl (nach Methylphenidat).67 Während der aktuelle Text der S3-Leitlinie von 2017 noch mitteilt, dass Lisdexamfetamin erst nach einer vorausgehenden Behandlung mit MPH zulassungskonform eingesetzt werden könne8, wird 2019 die S3-Leitlinie dahin gehend zitiert, dass als erste Option bei Erwachsenen mit ADHS eine Behandlung mit Psychostimulanzien empfohlen werde, unter welche die für Erwachsene zugelassenen Wirkstoffe Methylphenidat und Lisdexamfetamin fielen.910
Aufgrund des zu MPH abweichenden Responder/Nonresponderprofils eignen sich Amphetaminmedikamente besonders bei ADHS-Betroffenen, die auf MPH nicht ansprechen, und zwar eindeutig vor dem Einsatz von Nichtstimulanzien (z.B. noradrenergen Medikamenten oder trizyklischen Antidepressiva).11 Eine Zusammenfassung mehrerer Untersuchungen berichtet von 69 % Ansprechrate auf Amphetamin-Medikamente, 59 % Ansprechrate auf Methylphenidat. 87 % der Betroffenen hätten auf einen der beiden Wirkstofftypen angesprochen.12
Amphetaminmedikamente eignen sich daneben – anders als MPH – zur Mitbehandlung komorbider Dysphorie oder Depression.1314
Alle Amphetaminmedikamente wirken bei Erwachsenen laut einer Cochrane-Studie intraindividuell gleichermaßen gut, unabhängig von der spezifischen Medikamentenform.15 Damit unterscheiden sich Amphetaminmedikamente von Methylphenidat, bei dem bereits ein Wechsel zu einem anderen Methylphenidat-Präparat erhebliche individuelle Unterschiede zeigt.
Bei Studien zur Wirkung von Amphetamin muss immer beachtet werden, dass diese
- AMP meist in deutlich höheren Dosen verwenden als bei einer ADHS-Medikamentierung
- unretardiertes / nicht via Prodrug verlängert wirkendes AMP verwenden
- häufig AMP injizieren, was nochmals eine sehr viel schnellere Verstoffwechselung bewirkt
- diese 3 Faktoren sich in der Wirkung multiplizieren
Unzweifelhaft wirkt AMP in Medikamentenform anders als AMP in Drogenform.
- 1. Wirkstoffe von Amphetamin-Medikamenten
- 2. Amphetamin-Medikamente wirken anders und an anderen Stellen des Gehirns als Methylphenidat
- 2.1. Dopamin bei Amphetaminmedikamenten
- 2.1.1. Wirkung auf DAT
- 2.1.2. Vesikuläre Freisetzung
- 2.1.3. D2-Autorezeptor-Aktivierung
- 2.1.4. Erhöhung der Tyrosinhydroxylase
- 2.1.5. Erhöhte DA-Feuerung / Aktivierung in dopaminergen Gehirnregionen
- 2.1.6. Verringerte DA-Feuerung im Nucleus accumbens
- 2.1.7. DA-Beeinflussung indirekt über Auswirkungen auf von anderen Hirnregionen ausgehende Dopaminzellen
- 2.1.8. Downregulation von Dopaminrezeptoren?
- 2.2. Noradrenalin bei Amphetaminmedikamenten
- 2.3. Monoaminabbauhemmung via MAO
- 2.4. Serotoninfreisetzung
- 2.5. Wirkung auf HPA-Achse
- 2.6. Inhibition von OCT2
- 2.7. Sonstige Wirkungsweise auf Gehirnfunktionen
- 2.8. Überblick zu AMP und Neurotransmittern
- 2.1. Dopamin bei Amphetaminmedikamenten
- 3. Wirkung von Amphetaminmedikamenten im Vergleich zu MPH / Atomoxetin
- 4. Wirkung auf ADHS-Symptome
- 5. Ansprechrate (Responding / Nonresponding)
- 6. Keine geschlechtsspezifischen Wirkungsunterschiede
- 7. Wirkung bei niedrigen Dosen beruhigend, bei hohen Dosen aktivierend
- 8. Dosierung Amphetamin-Medikamente oder MPH
- 9. Wirkungsprofil (zeitlich) / Wirkdauer
- 10. Anwendungsbereiche von Amphetaminmedikamenten im Verhältnis zu MPH
- 11. Nebenwirkungen
- 12. Abbau von Amphetamin
- 13. Kontraindikationen und Wechselwirkungen
- 13.1. Verkürzte Halbwertszeit (verringerte Wirkung)
- 13.2. Verlängerte Halbwertszeit (erhöhte Wirkung)
- 13.3. Verzögerte Wirkung
- 13.4. Verstärkende Wirkung auf Amphetamine
- 13.5. Abschwächende Wirkung auf Amphetamine
- 13.6. Wenig Wechselwirkungen von AMP auf andere Medikamente
- 13.7. AMP in der Schwangerschaft
- 14. Langzeitwirkung: Keine Gewöhnungseffekte von Amphetaminmedikamenten
- 15. Präparate
- 16. Auslandsmitnahme von Amphetaminmedikamenten
1. Wirkstoffe von Amphetamin-Medikamenten
AMP hat ein chirales Zentrum mit zwei Enantiomeren:16
- Levo-AMP (l-AMP)
- Noradrenalinfreisetzung so stark wie oder stärker als d-AMP
- Dextro-AMP (d-AMP)
- höhere Dopaminfreisetzung als l-AMP
In der Folge bewirken die in den USA erhältlichen Amphetamin-Mischsalz-Präparate, die zu gleichen Teilen aus racemischem d,l-AMP-Sulfat, d,l-AMP-Aspartat-Monohydrat und zwei enantiomerenreinen d-AMP-Salzen (d-AMP-Sulfat und d-AMP-Saccharat) bestehen, was ein Verhältnis von 3:1 zwischen d-AMP- und l-AMP-Isomeren und Salzen ergibt, eine relativ größere Noradrenalinfreisetzung als reines d-AMP, bei absolut betrachtet immer noch größerer Dopamin- als Noradrenalinfreisetzung.
Für die ADHS-Behandlung relevant sind:
1.1. Dextroamphetamin (D-Amphetamin)
Dextroamphetamin wird auch Dexamphetamin oder Dextroamphetaminsulfat genannt.
Dextroamphetamin ist das rechtsdrehende (D-)Enantiomer von Amphetamin, gegenüber dem linksdrehenden Levoamphetamin (siehe unten).
D-Amphetaminmedikamente wirken 3- bis 4-mal stärker auf das zentrale Nervensystem als racemische Amphetaminmedikamente, bei gleichzeitig geringerer sympathikomimetischer Wirkung in der Peripherie, weshalb D-Amphetaminmedikamente bei der ADHS-Behandlung bevorzugt werden.17
D-Amphetamin ist nur in Bezug auf die Dopamintransporter potenter als L-Amphetamin, während die Wirkung auf Noradrenalintransporter in etwa gleich ist.18
Dies eröffnet die Möglichkeit, die Medikation dopaminerg zu betonen (Dexamphetamin) oder ausgeglichen dopaminerg und noradrenerg (Levoamphetamin) zu gestalten.
D-Amphetamin sei im Vergleich zu MPH aktivierender und daher bei ADHS-I bevorzugt zu empfehlen.19
Auch bei paralleler Dysthymie / Dysphorie / Depression ist es aufgrund der spürbaren serotonergen Wirkung20 oft besser wirksam als MPH.
1.1.1. Dextroamphetamin ohne Lysinbindung
Handelsname: Attentin (D seit Ende 2011), Dexamin (Schweiz: als Magistralrezeptur), Dexedrin
Wirkdauer ca. 6 Stunden, sodass meist eine 2x tägliche Einnahme nötig ist.
Erhöhtes Missbrauchspotential, da keine Lysinbindung.
Medice (2017): Attentin® – Leitfaden für verschreibende Ärzte
1.1.2. Dextroamphetamin aus Lisdexamfetamin (mit Lysinbindung)
Lisdexamfetamin (LDX) ist ein Prodrug von D-Amphetamin, das an L-Lysin zu einer an sich unwirksamen Substanz gebunden ist. Lisdexamfetamin ist also ein Wirkstoff, der erst im Körper zum eigentlich wirksamen Stoff, hier D-Amphetamin, umgewandelt wird. Dadurch besteht eine sehr geringe Missbrauchsgefahr.21 Dennoch ist die Wirkung dosisabhängig linear bis zu 250 mg. Einen Schutz vor Überdosierung bietet LDX daher nicht.22
Das an Lysin gebundene Lisdexamfetamin (LDX) wird aus dem Dünndarm schnell in den Blutkreislauf aufgenommen. Des erfolgt durch aktiven Transport, vermutlich durch den Peptidtransporter 1 [PEPT1]. Die enzymatische Hydrolyse der Peptidbindung zur Freisetzung von d-Amphetamin im Blut erfolgt im Lysat und im zytosolischen Extrakt menschlicher Erythrozyten, nicht aber in der Membranfraktion. Diese Umwandlung wird durch einen Proteaseinhibitor-Cocktail, Bestatin und Ethylendiamintetraessigsäure stark gehemmt, was auf eine Aminopeptidase als Ursache der hydrolytische Spaltung der LDX-Peptidbindung hindeutet. Aminopeptidase B scheint es nicht zu sein.23
Durch den erforderlichen und langsamen Umwandlungsschritt von LDX zu d-AMP tritt die Wirkung ca. 1 Stunde später ein als bei Einnahme von d-AMP-Sulfat.22 Anders als LDX überwindet das pharmakologisch aktive d-AMP die Blut-Hirn-Schranke und gelangt ins ZNS, wo es seine Wirkung ausübt.16
Da die Wirkung über die Wirkdauer recht gleichmäßig ist, entfallen die von MPH bekannten unangenehmen Reboundeffekte (kurzfristige erhöhte Unruhe bei Wirkende) oder sidn deutlich schwächer.
Die Wirkung entspricht D-Amphetamin. Eine Umrechnungstabelle von Dexamphetamin zu Elvanse findet sich bei ADHSpedia.24 Weitere Umrechnungstabellen gibt es von Kühle25und für amerikanische Präparate bei Stutzman et al.26
Handelsnamen:
- Elvanse (EU, seit Ende 2013, für Kinder, 20, 30, 40, 50, 60, 70 mg)27
- Elvanse Adult (EU, seit 01.05.19, für Erwachsene, 30, 50, 70 mg)27. Seit 2023 sind in Deutschland auch 20, 40 und 60 mg zugelassen.
- Elvanse und Elvanse adult wurden in 2023 zu einem gemeinsamen Medikament mit einheitlicher Zulassung zusammengefasst. Es handelte sich bereits bisher um ein identisches Produkt. Seit März 2024 ist Elvanse in 20, 30, 40, 50, 60 und 70 mg in Deutschland für Kinder und Erwachsene erhältlich.
- Vyvanse (USA) ist in Dosen von 10 mg bis 70 mg erhältlich28 Lisdexamfetamin ist in den USA auch gegen Binge-Eating zugelassen.29
- Tyvense (USA) ist in Dosen von 20 mg bis 70 mg erhältlich
- Teva-Lisdexamfetamine (Canada) ist in Dosen von 10 mg, 20 mg, 30 mg, 40 mg, 50 mg, 60 mg und 70 mg erhältlich30
Generika:
- Seit August 2024 ist in Deutschland Lisdexamfetaim als Generikum (Lisdexamfetamin Ratiopharm) erhältlich, wobei auch 100-Kapsel-Packungen auf dem Markt sind.
Lisdexamfetamin ist in Deutschland erst seit 2013 als BtM eingestuft.
Österreich scheint das einzige Land zu sein, in dem Elvanse auch Stand 2023 nicht als Betäubungsmittel (österreichische Bezeichnung: Suchtgift) klassifiziert ist.31
Aufgrund der lang anhaltenden Wirkung unterliegt Lisdexamfetamin einer Steady State Bildung. Der Steady State scheint an Tag 5 erreicht zu werden.32 Daraus folgt, dass bei der Eindosierung von Lisdexamfetamin (Elvanse) Dosistitrationen nicht unterhalb eines Wochenrhythmus erfolgen sollten.
1.2. Levoamphetamin (L-Amphetamin)
Levoamphetamin (L-Amphetamin) ist das rein linksdrehende Isomer von Amphetamin.
L-Amphetamin ist in Bezug auf die Dopamintransporter weniger potent als D-Amphetamin, während die Wirkung auf Noradrenalintransporter in etwa gleich ist.18 Dadurch wirkt es etwas mehr noradrenerg als D-Amphetamin, jedoch immer noch überwiegend dopaminerg.33
L-Amphetamin erhöht Blutdruck und Puls stärker als D-Amphetamin.34
Uns ist kein in Europa zugelassenes L-Amphetamin-Fertigmedikament bekannt. Es müsste auf Einzelrezept in Apotheken hergestellt werden.
1.3. Gemischte Amphetaminsalze / Amphetamin-Derivate
- Aderall (USA): 75 % Dextroamphetamin und 25 % Levoamphetamin
- Evekeo (USA): 50 % Dextroamphetamin und 50 % Levoamphetamin
Amphetamin-Mischsalze sind eine Kombination verschiedener Stimulanzien:35
D-Amphetamin-Saccharat
D-Amphetamin-Sulfat
D,L-Amphetamin-Sulfat
D,L-Amphetamin-Aspartat-Monohydrat
Während in den USA D,L-Amphetaminsulfatmischungen die meistgenutzten ADHS-Medikamente sind, sind D,L-Amphetemin-Mischungen in Deutschland nur in wenigen Apotheken erhältlich, die diese selbst herstellen. Die Herstellung ist mit mehreren Wochen Wartezeit verbunden. Als Kosten wurden 200 € für 180 Kapseln zu je 5 mg Amphetaminsulfat genannt.
1.4. Methamphetamin
- Desoxyn, USA
Methamphetamin ist in Deutschland nicht verschreibungsfähig.
(1.5. Fenetyllin)
- Captagon (in D bis 2003; in Belgien bis 2010); heute nicht mehr erhältlich
2. Amphetamin-Medikamente wirken anders und an anderen Stellen des Gehirns als Methylphenidat
Amphetamin-Medikamente haben einen komplexeren Wirkmechanismus als Methylphenidat.
Die Darstellung der Wirkung von Amphetaminmedikamenten ist widersprüchlich.
Es wird zuweilen vertreten, dass Amphetaminmedikamente lediglich die Dopaminwiederaufnahme hemmen und Dopamin und Noradrenalin freisetzen. Fundiertere Darstellungen aus den USA (wo Amphetaminmedikamente häufiger verschrieben werden als in Europa und wo daher eine intensivere Auseinandersetzung damit erfolgt) nennen als Wirkung eine Wiederaufnahmehemmung von Dopamin- und Noradrenalintransportern und keine Freisetzung von Dopamin, Noradrenalin oder Serotonin.
In den USA erhalten Jugendlichen mit ADHS zu 52,9 % MPH und 39,3 % Amphetaminmedikamente als erstes verschriebenes Medikament. Im Verlauf der Behandlung ist MPH bei rund 40 % das primär verschriebene Medikament und 33 % AMP das primär verschriebene Medikament.36
Grundsätzlich sollen Amphetaminmedikamente intraneuronal wirken, während Methylphenidat und Atomoxetin extraneuronal wirken.37 Da Amphetaminmedikamente zumindest auch den Dopamintransporter und den D2-Autorezeptor adressieren, dürfte dies nicht haltbar sein.
AMP wirkt primär im Striatum sowie weiter im Cortex und im ventralen Tegmentum.38
Inzwischen existieren erste Computermodelle, die die Wirkung von ADHS-Medikamenten ernsthaft simulieren können. Ein Computermodell für die Simulation von Typ-1-Diabetes wurde von der FDA bereits als Ersatz von präklinischen Tierstudien zugelassen.39
Ein Modell zum Vergleich von MPH und AMP bei Kindern und Erwachsenen mit ADHS berücksichtigt die Wirkung auf 99 Proteine, die bei ADHS involviert sind.40
2.1. Dopamin bei Amphetaminmedikamenten
Die Dopaminerhöhung durch D-Amphetamin im PFC ist sehr viel ausgeprägter und zudem deutlich dosisabhängiger als bei MPH, mithin besser steuerbar.37
AMP bewirkt:
- extrazelluläre Dopaminspiegel 6-fach erhöht41
- tonische Dopaminfeuerung verstärkt, indem AMP die vesikulären Speicher leert und die nicht-exozytotische Freisetzung durch umgekehrten Transport fördert42
- phasische Dopaminfeuerung: widersprüchliche Angaben
- verstärkt, indem es die vesikuläre Dopaminfreisetzung hochreguliert42
- Stimulanzien verringern die phasische Dopaminfreisetzung41
- AMP förderte die Ausschüttung von Dopamin aus Vesikeln, indem es die Affinität der Vesikel für die Dopamin-Aufnahme verringerte (von K(m) 0,8 auf K(m) 32). Die pro Puls freigesetzte Dopamin-Menge verringerte sich jedoch um 82 % (nach anderer Quelle um 25 bis 50 %). Der D2-Antagonist Sulpirid verringerte die Freisetzungshemmung, förderte also die Ausschüttung. Diese war bei D2-KO-Mäusen reduziert. Bei gehemmten D2-Autorezeptoren erhöhte AMP das extrazellulär freigesetzte Dopamin.43
- AMP verringert vesikuläre Freisetzung4445 (dies kann die tonische wie die phasische Freisetzung betreffen)
2.1.1. Wirkung auf DAT
2.1.1.1. Dopamin(wieder)aufnahmehemmung via DAT und NET
Stimulanzien (MPH wie AMP hemmen die Dopaminwiederaufnahme46 und führen (in niedrigen Dosen) dadurch zu einem 6-fach erhöhten extrazellulären Dopaminspiegel.41
Der so erhöhte extrazelluläre Dopaminspiegel wirkt auf präsynaptische Dopamin-D2-Autorezeptoren an der Nervenendigung. Die D2-Autorezeptor-Aktivierung bewirkt eine um das 2- bis 3-fach erhöhte impulsassoziierte (phasische) Dopaminfreisetzung. Diese Erhöhung ist also relativ geringer als Anstieg des extrazellulären Dopamins. Der (relativ geringere) Anstieg des phasischen Dopamins wirkt auf die postsynaptischen D2-Dopaminrezeptoren und bewirkt eine verringerte lokomotorische Aktivität. Höhere Dosen von Stimulanzien erhöhen extrazelluläres Dopamins stärker und führen zu einer deutlichen Verhaltensstimulation, die durch die phasische Aktivierung der hemmenden postsynaptischen D2-Rezeptoren nicht überwunden werden kann. Hohe D-Amp Dosen bewirken eine Übersättigung extrazellulärer postsynaptischer D1- und D2-Rezeptoren, sodass sie die inhibierende präsynaptische Wirkung niedriger D-AMP-Dosen überragen.41
- Amphetaminmedikamente blockieren die Dopamin- und Noradrenalintransporter auf eine andere Art und Weise als Methylphenidat. Während die Wiederaufnahmehemmung von MPH der von Antidepressiva gleicht, wirken Amphetaminmedikamente als kompetitiver Inhibitor und Pseudosubstrat auf Dopamin- und Noradrenalintransporter und binden an der gleichen Stelle an, an der die Monoamine an den Transporter binden, wodurch die NE- und DA-Wiederaufnahme ebenfalls gehemmt wird.47
- D-Amphetamin wirkt
- “Amphetamines can also stabilize dopamine and noradrenaline transporters in channel configurations, reverse flow through intracellular vesicular monoamine transporters, and cause internalization of dopamine transporters”49
D-AMP-Medikamentendosen bewirken eine D-AMP-Plasmakonzentration von rund 150 nM, was ausreicht, um einen erheblichen Teil der Dopamintransporter zu besetzen. Diese Wirkung deckt sich mit der von MPH.41 - D-Amphetamin hat in etwa die dreifache Affinität auf die Noradrenalintransporter (NET) zur Wiederaufnahmehemmung und die zweieinhalbfache Affinität auf Dopamintransporter (DAT) im Vergleich zu racemischem Methylphenidat.37
2.1.1.1.1. DAT-Hemmung via PKC
- AMP hemmt DAT möglicherweise via PKC50
- Mehrere Proteinkinasen regulieren die DAT-Funktion5152
- AMP erhöht die Aktivität der striatalen partikulären PKC über einen kalziumabhängigen Signalpfad53
- PKC-Aktivierung führt zu einer Phosphorylierung im N-Terminal des striatalen DAT der Ratte54
- Eine PKC-Aktivierung stimuliert die DAT-vermittelte Dopamin-Freisetzung50
- PKC-Inhibitoren und die Herunterregulierung von PKC50
- hemmen Efflux
- lassen Dopamin-Aufnahme unverändert
2.1.1.2. Dopaminfreisetzung (DAT-Efflux) erhöht
Der erhöhte DAT-Efflux erhöht extrazelluläres Dopamin.
Amphetaminmedikamente setzen Dopamin in den Extrazellulärraum frei.374846
Amphetamine wirken demnach nicht nur als Dopaminwiederaufnahmehemmer, sondern sie kehren darüber hinaus die DAT-Funktion um, sodass die DAT nicht nur kein Dopamin wiederaufnehmen, sondern es aus der Zelle ausschütten (Efflux).55
Es handelt sich dabei um neu synthetisiertes Dopamin. Unzweifelhaft ist, dass es sich nicht um eine Entleerung der Dopaminvorräte handelt, da Amphetaminmedikamente andernfalls keine dauerhafte Wirkung haben könnten.
Fraglich ist, ob es sich um Dopamin handelt, das zuvor in Vesikel eingelagert wurde. Unzweifelhaft ist, dass Amphetamindrogen (drogencharakteristisch: hohe Dosis, schnell appliziert, schnelles Wirkungsende) Dopamin freisetzen. Es ist fraglich, ob dies bei Amphetaminmedikamenten (charakteristisch: medikamentös = niedrig dosiert, langsam freigesetzt, lang anhaltende Wirkung) ebenfalls der Fall ist, und falls ja, in welchem Maße dies gegeben ist.
2.1.1.2.1. Via VMAT2 bei hohen Dosen
- (Erst) bei einer sehr hohen Dosierung als Droge wirken Amphetamine auch auf den Vesikulären Monoamintransporter 2 (VMAT2) für Dopamin und Noradrenalin und lösen dann eine sich kumulierende Dopaminausschüttung aus den synaptischen Vesikeln aus. Danach wird die hohe Dopaminmenge durch eine Wirkungsumkehr der Dopamintransporter in den synaptischen Spalt ausgekehrt. Dieser Mechanismus greift nicht bei der üblichen Dosierung als ADHS-Medikament.18 Anders formuliert: Amphetamine können in präsynaptische Monoamin-Vesikel eindringen und einen Efflux von Neurotransmittern in Richtung Synapse verursachen.56
- Eine Gabe von 1 mg/kg AMP (injiziert) verursachte bereits einen Dopamin-DAT-Efflux, der bei 10 mg/kg deutlich höher war.57
2.1.1.2.2. Durch Erhöhung von intrazellulärem Ca2+
AMP erhöht intrazelluläres Ca2+, was die Phosphorylierung von DAT am N-Terminus des Transporters unterstützt. Phosphorylierung (durch CaMKII und möglicherweise auch durch PKCβ) erhöht Wahrscheinlichkeit für DAT-Efflux von zytoplasmatischem DA.58
2.1.1.2.3. Erhöhter DAT-Efflux via TAAR1
- AMP wirkt via TAAR1 auf DAT
Amphetamin ermöglicht dem Spurenamin-assoziierten Rezeptor 1 (TAAR1), den DAT-Transporter zu phosphorylieren. Dadurch wird die Wiederaufnahme von Dopamin unterbrochen und der DAT wird zur Ausschüttung von Dopamin angeregt (Efflux).56 - AMP führt auch zu einer erhöhten intrazellulären Akkumulation von DAT59
2.1.2. Vesikuläre Freisetzung
- AMP verringert die vesikuläre Freisetzung, weil AMP als lipophile schwache Base und als Substrat für den VMAT die Umverteilung von Dopamin aus den synaptischen Vesikeln in das Zytosol fördert, indem es den vesikulären pH-Gradienten zusammenbrechen lässt.44 Dadurch verringert AMP die Anzahl der pro Vesikel freigesetzten Dopamin-Moleküle.45
- Amphetamin verringert zunächst die VMAT2, während lang anhaltende Gabe diese erhöht.60 MPH erhöht VMAT2 per se.6162
- AMP kann die vesikuläre Freisetzung hemmen, indem es indirekt D2-Autorezeptoren aktiviert. Die Aktivierung von D2-Autorezeptoren reguliert Kaliumkanäle, die ihrerseits die Wahrscheinlichkeit der exozytären Dopamin-Freisetzung regulieren.45
- Ein Computermodell ermittelte:63
- eine maximale Dopaminfreisetzung bei 0,5-1,0 mg/kg AMP (niedriger bei geringeren wie bei höheren Dosen)
- das meiste freigesetzte Dopamin resultierte aus durch AMP angeregter Dopaminneusynthese
- das produzierte Dopamin wurde unmittelbar in DOPAC umgewandelt, das extrazellulär ausgeschieden wird
- das Dopamin wurde nicht in Vesikel eingelagert
- Nach Auffassung von Stahl schüttet AMP jedenfalls bei niedrigen Dosen kein Dopamin aus.18
- AMP bewirkte bei Wildtyp-Mäusen in vitro wie in vivo einen allmählichen Anstieg des extrazellulären Dopamins im Striatum über ca. 30 Minuten um das 10-fache, wobei gleichzeitig der für die elektrisch stimulierte Ausschüttung zur Verfügung stehende Dopaminpool reduziert wird. Wurde das vesikuläre Dopamin zuvor durch Reserpin ins Cytosol ausgeschüttet, erhöhte sich das extrazelluläre Dopamin nicht; dennoch bewirkte AMP einen schnellen Dopaminanstieg binnen 5 Minuten. Bei DAT-KO-Mäusen stieg das extrazelluläre Dopamin nicht an, bei allerdings zugleich ebenfalls reduzierter elektrisch stimulierbarer Dopamin-Freisetzung. DAT sind mithin für die dopaminfreisetzende Wirkung von AMP erforderlich, nicht aber für die vesikelentleerende Wirkung. Die Dopamin-Entleerung der Vesikel ist der geschwindigkeitsbegrenzende Schritt für die AMP-Wirkung auf Dopamin.64
- AMP (10 Mikrom) förderte die Ausschüttung von Dopamin aus Vesikeln, indem es die Affinität der Vesikel für die Dopamin-Aufnahme verringerte (von K(m) 0,8 auf K(m) 32 Mikrom). Die pro Puls freigesetzte Dopamin-Menge verringerte sich jedoch um 82 % (nach anderer Quelle um 25 bis 50 %). Der D2-Antagonist Sulpirid verringerte die Freisetzungshemmung, förderte also die Ausschüttung. Diese war bei D2-KO-Mäusen reduziert.
Bei gehemmten D2-Autorezeptoren erhöhte AMP das extrazellulär freigesetzte Dopamin.43
- Entleerung der vesikulären DA-Speicher durch schwach basische Wirkung auf den intravesikulären pH-Gradienten. Der intravesikuläre pH-Gradient ist zur Konzentration von DA erforderlich.
- Unterschiedliche Wirkung auf freisetzungsbereite Vesikel und Reservepool-Vesikel:42
- reizabhängige Wirkung im dorsalen Striatum
- vesikuläre Dopaminfreisetzung angeregt
- durch eine Feuerung von kurzer Dauer
- via freisetzungsbereiten Vesikel-Pool
- Freisetzung verringert
- durch eine Feuerung von langer Dauer
- der auf Reservepool zugreift
- diese gegensätzlichen Wirkungen der vesikulären Dopaminfreisetzung waren mit gleichzeitigem Anstieg der tonischen und phasischen Dopaminreaktionen verbunden
- vesikuläre Dopaminfreisetzung angeregt
- im ventralen Striatum
- nur erhöhte vesikuläre Freisetzung und erhöhte phasische Signale
- reizabhängige Wirkung im dorsalen Striatum
2.1.3. D2-Autorezeptor-Aktivierung
Grundsätzlich aktiviert D-Amphetamin D2-Dopamin-Autorezeptoren im Striatum.65
Medikamentöse Dosen von D-AMP bewirken jedoch keine signifikante Verringerung der Dopaminausschüttung über Aktivierung der D2-Autorezeptoren.6667
Da Medikamente wie Levodopa oder Piribedil keine positive Wirkung bei ADHS zeigen, obwohl diese eine die Feuerrate der dopaminergen Neuronen der Substantia nigra pars compacta verringern, ist zweifelhaft, ob die Verringerung der Hyperaktivität bei ADHS durch Stimulanzien auf einer präsynaptische Hemmung basiert. Vermutlich beruht die Verringerung der Hypermotorik durch Stimulanzien bei ADHS eher auf einer Erhöhung der Dopaminausschüttung.66
2.1.4. Erhöhung der Tyrosinhydroxylase
Amphetaminmedikamente scheinen einen aktivierenden Einfluss auf die Tyrosinhydroxylase im dorsalen Striatum und im Nucleus accumbens zu haben, der zu einem erhöhten L-Dopa-Spiegel führt, was jedoch offenbar nicht über eine Veränderung der Phosphorylierung der Tyrosinhydroxylase geschieht.68
2.1.5. Erhöhte DA-Feuerung / Aktivierung in dopaminergen Gehirnregionen
2.1.5.1. Erhöhte DA-Feuerung in Nucleus caudatus / Putamen (Striatum)
Eine hohe (deutlich über Medikamentendosis) D-Amphetamin-Gabe (2,5 bis 10 mg/kg bei der Ratte in die Bauchhöhle), führt zu einem erhöhten dopaminergen Feuern im Nucleus caudatus und Putamen und bewirkt fokussiert-repetitives (stereotypes) Verhalten.6970 Der D2-Antagonist Haloperidol (2 mg/kg) beendet die überhöhte Feuerung im Nucleus caudatus und Putamen und die verringerte Feuerung im Nucleus accumbens.69
2.1.5.2. Erhöhte DA-Feuerung in VTA und Substantia nigra
D2-Antagonisten unterbinden die erhöhte Feuerung in Substantia nigra und VTA (in vivo).71
2.1.5.3. Erhöhte Aktivierung in rechtem orbitofrontalem Kortex, linkem mittleren Frontallappen, oberem Frontallappen und präcentralen Gyri
Die Verbesserung der ADHS-Symptome durch LDX ging mit einer signifikant erhöhten Aktivierung in einer Reihe von Hirnregionen einher, die zuvor bei der Verstärkungsverarbeitung unter Wahl- und Feedback-Bedingungen eine Rolle gespielt hatten (z. B. linkes Caudat und Putamen, rechter orbitofrontaler Kortex, linker mittlerer Frontallappen, oberer Frontallappen und präcentrale Gyri).72
2.1.6. Verringerte DA-Feuerung im Nucleus accumbens
Im Nucleus accumbens führten 7,5 mg / kg D-Amp zu einer Verringerung des dopaminergen Feuerns.69 Der D2-Antagonist Haloperidol (2 mg/kg) beendet die überhöhte Feuerung im Nucleus caudatus und Putamen und die verringerte Feuerung im Nucleus accumbens.69
2.1.7. DA-Beeinflussung indirekt über Auswirkungen auf von anderen Hirnregionen ausgehende Dopaminzellen
Amphetamin scheint die Aktivität der Dopaminzellen indirekt über seine Auswirkungen auf die von anderen Hirnregionen ausgehenden Dopaminzellen zu beeinflussen.73
Amphetamin kann Dopamin-Neuronen durch Modulation der Glutamat-Neurotransmission erregen. Amphetamin hemmt stark die vom metabotropen Glutamatrezeptor (mGluR) vermittelten inhibierenden postsynaptischen Potenziale in Dopamin-Neuronen, hat aber keine Auswirkungen auf die vom ionotropen Glutamatrezeptor vermittelten exzitatorischen postsynaptischen Ströme. Amphetamin desensibilisiert die mGluR-vermittelte Hyperpolarisation durch:74
- DA-Freisetzung
- Aktivierung postsynaptischer alpha1-adrenerger Rezeptoren
- Unterdrückung der InsP3-induzierten Kalziumfreisetzung aus internen Speichern
Durch die selektive Unterdrückung der hemmenden Komponente der Glutamat-vermittelten Übertragung kann Amphetamin das Burst-Feuern von Dopamin-Neuronen fördern und so die phasische Freisetzung von Dopamin steigern.
2.1.8. Downregulation von Dopaminrezeptoren?
Berichte über eine unmittelbare Downregulation von Dopaminrezeptoren durch eine Gabe von Amphetamin stützen sich auf Studien, in denen Ratten Amphetamine in Drogendosis gegeben wurden. Dies betrifft die Dosierungshöhe (5, 10, 15 mg/kg für 4 oder 20 Tage zweimal täglich) als auch die Form (Spritze).75 Interessanterweise erhöhte eine Einmalgabe von D-AMP sogar die Rezeptoranzahl.7567
Berichte über eine Downregulation bei Gabe in Medikamentendosis und -form sind uns bislang nicht bekannt.
Ebenso scheinen nur Studien mit Drogendosen von Amphetaminen zur Veränderung des Dopaminrezeptoraffinität bzw. des Rezeptorstatus von hochaffin zu niedrigaffin zu existieren. Drogendosen könnten das Gleichgewicht zwischen den Rezeptorstatus in Richtung niedrigaffin verändern.67
Mehr zum Rezeptorstatus unter Hochaffiner und niedrigaffiner Rezeptorstatus im Beitrag Dopaminwirkung an Rezeptoren
Denkbar wäre allerdings, dass Amphetamin in Medikamentendosis nicht unmittelbar, sondern über den Umweg der Erhöhung des extrazellulären Dopaminspiegels eine Desensibilisierung der postsynaptischen bzw. extrasynaptischen (die Mehrheit der Dopaminrezeptoren sitzt außerhalb von Synapsen) D1- und D2-Rezeptoren bewirkt. Diese Hypothese ist bislang allerdings noch nicht experimentell belegt.67 Möglicherweise führt dieser Weg zur reduzierten psychomotorischen Aktivität durch Amphetaminmedikamente. Hiergegen spricht aus unserer Sicht jedoch, dass diese Wirkung bereits mit der ersten Einnahme eintritt. Andererseits könnte dieser Weg erklären, warum viele Betroffene von einer langsamen und kleinschrittigen Titration von Stimulanzien profitieren,
2.2. Noradrenalin bei Amphetaminmedikamenten
2.2.1. Noradrenalinwiederaufnahmehemmung via NET
- Amphetaminmedikamente blockieren die Dopamin- und Noradrenalintransporter auf eine andere Art und Weise als Methylphenidat. Während die Wiederaufnahmehemmung von MPH der von Antidepressiva gleicht, wirken Amphetaminmedikamente als kompetitiver Inhibitor und Pseudosubstrat auf Dopamin- und Noradrenalintransporter und binden an der gleichen Stelle an, an der die Monoamine an den Transporter binden, wodurch die NE- und DA-Wiederaufnahme ebenfalls gehemmt wird.4776
- “Amphetamines can also stabilize dopamine and noradrenaline transporters in channel configurations, reverse flow through intracellular vesicular monoamine transporters, and cause internalization of dopamine transporters”49
- D-Amphetamin hat in etwa ein Drittel der Wiederaufnahmehemmung auf die Noradrenalintransporter (NET) und Dopamintransprter (DAT) wie racemisches Methylphenidat.37
- Amphetamin (wie auch Ephedrin) hemmen auch auf den intrazellulären Noradrenalintransporter, der Noradrenalin aus der Nervenzelle in die Vesikel (die Neurotransmitterspeicher) aufnimmt76
2.2.2. Noradrenalinfreisetzung
- Ob Amphetamin in Medikamentendosierung noradrenalinausschüttend wirkt, wird ebenso wie bei Dopamin konträr diskutiert. Es gibt Stimmen dagegen18 wie dafür.4648
- D-Amphetamin erhöht sekundär die Noradrenalinfreisetzung.65 Dies ist bei dopaminergen Medikamenten aufgrund der Umwandlung von Dopamin (zu ca. 5 – 10 %) in Noradrenalin stets der Fall.
- Unzweifelhaft führen Amphetaminmedikamente nicht zu einer chronischen Entleerung der Noradrenalinvorräte im Sinne eines Mangelzustands. Es ist empirisch gesichert, dass Amphetaminmedikamente bei ADHS auch langfristig keine Gewöhnungseffekte bewirken
2,5 mg/kg AMP bewirkte bei Mäusen:77
- stereotypes Verhalten (ein Zeichen stark erhöhten extrazellulären Dopamins); ebenso stark wie 20 mg/kg MPH
- extrazelluläres Dopamin erhöht
- extrazelluläres Noradrenalin erhöht
- extrazelluläres Serotonin erhöht
2.2.3. Verringerung von Noradrenalinmetaboliten nur bei Respondern
- In mehreren voneinander unabhängigen Studien wurde festgestellt, dass D-Amphetaminmedikamente den Metaboliten von Noradrenalin, MHPG, im Urin verringern. Der Rückgang von MPHG im Urin soll ein wichtiger Indikator für ein Anschlagen von Stimulanzien sein, der auf ein Absenken des Noradrenalinniveaus durch Dextroamphetaminmedikamente hindeutet.78](https://psycnet.apa.org/psycinfo/1982-21744-001)
- Die Noradrenalinmetabolitenverringerung tritt zudem nur bei den ADHS-Betroffenen auf, die auf Dexamphetamin positiv ansprechen (Responder).79
- Auch bei der Gabe von Methylphenidat zeigten nur die Responder einen signifikanten Rückgang von MPHG im Urin, während bei den Nonrespondern MPHG im Urin nicht zurückging.80
Die Autoren schließen daraus auf ein verringertes Noradrenalinniveau bei ADHS. - Weiterhin wurde in mehreren Untersuchungen mit ADHS-Betroffenen festgestellt, dass Verhaltensverbesserungen proportional zum (mittels D-Amphetaminmedikament) verringerten Noradrenmetabolitenalinniveau standen.81
Im Gegensatz zur Verringerung der Metaboliten im Urin durch D-Amphetamin ist die durch D-Amphetamin vermittelte Noradrenalinerhöhung im PFC in etwa so ausgeprägt wie die von MPH, jedoch deutlich dosisabhängiger, mithin besser steuerbar.37
2.2.4. DA-Feuerung und DA-Bursting erhöht via Noradrenalin-α1-Rezeptoren
D-Amp (1 bis 2 mg/kg) wirkt via Alpha1-Adrenozeptoren82 (nicht aber via Alpha2- oder Beta-Adrenozeptoren) erhöhend auf das dopaminerge Feuern und Bursting in Substantia nigra und VTA (in vivo). Dieser adrenerge Wirkweg wird normalerweise von der durch D2-Autorezeptoren vermittelten Verringerung des dopaminergen Feuerns überdeckt und durch D2-Antagonisten oder durch gleichzeitige Gabe von D1/D5 und D2/D3/D4-Blockierern sichtbar. Der selektive Norepinephrin-Aufnahmeblocker Nisoxetin erhöhte die DA-Feuerrate nicht, jedoch die DA-Bursts.7183
D-Amphetamin scheint im PFC den Noradrenalin-α1-Rezeptor zu aktivieren, da der α1-Rezeptor-Antagonist Prazosin die Wirkung von D-Amphetamin im PFC vollständig neutralisierte. Dagegen scheint D-Amphetamin weder den α2-Rezeptor noch den β-Rezeptor zu adressieren, da die Wirkung von D-Amphetamin bei einer Blockade der α2- oder β-Rezeptoren bestehen blieb.84
D-Amphetamin fördert den Up-Zustand kortikaler Neuronen mittels Aktivierung von85
- zentralen α1A-Adrenozeptoren
- D1-Rezeptoren
- D2-Rezeptoren
- jedoch nicht jeweils durch D1- oder D2-Rezeptoren allein
Der Dopamin/Noradrenalin-Vorläufer L-DOPA förderte den Up-Zustand dagegen nicht.
Arousal ist mit einem erhöhten Up-Zustand verbunden, während Slow-Wave-Schlaf, Vollnarkose und ruhiger Wachzustand von einem oszillierenden Wechsel zwischen Up- und Down-Zuständen gekennzeichnet sind. Bei Erregung enden die Down-Zustände und die Up/Down-Oszillation wechselt in einen anhaltenden Up-Zustand.
Die Up/Down-Oszillationen scheint für die Gedächtniskonsolidierung relevant zu sein, während der Übergang in einen dauerhaften Up-Zustand für Arousal und Aufmerksamkeit erforderlich ist.85
2.3. Monoaminabbauhemmung via MAO
Amphetaminmedikamente wirken als MAO-Hemmer,8638 anders als niedrigdosiertes MPH. Ob hochdosiertes MPH als MAO-Hemmer wirkt, ist unbekannt.37
MAO ist ein Enzym, das Dopamin und Noradrenalin in der Zelle abbaut. MAO-Hemmer erhöhen damit die Menge des in der Zelle verfügbaren Dopamins und Noradrenalins. Da Dopamin und Noradrenalin zusätzlich weiterhin in der Nervenzelle synthetisiert werden, steigen die Noradrenalin- und Dopaminwerte in der Zelle weiter an. Dies führt zu einer Umkehr der Wirkung der Transporter (die eigentlich DA und NE aus dem synaptischen Spalt in die Zelle zurückführen), sodass diese NE und DA in den synaptischen Spalt ausschütten, auch ohne dass dies durch ein Nervensignal ausgelöst wird, das zu übertragen wäre.86 Dieser Effekt löse peripher Bluthochdruck und Herzfrequenzanstieg aus. Da dieser Wirkmechanismus indirekt an der Präsynapse erfolgt, werden Ephedrin und Amphetaminmedikamente auch “indirekte Sympathomimetika” genannt, während Wirkstoffe, die direkt an den Rezeptoren der Postsynapse wirken, Sympathomimetika genannt werden.86
2.4. Serotoninfreisetzung
Amphetaminmedikamente sollen in geringem Maße Serotonin freisetzen.8717 Auch hier ist unklar, ob dies wirklich auch bei Dosierung auf Medikamentenniveau der Fall ist, oder ob diese Wirkung nur bei der Dosierung als Drogen beschränkt ist. Stahl berichtet jedenfalls nicht von einer serotonergen Wirkung von Amphetaminmedikamenten.47
2,5 mg/kg AMP bewirkte bei Mäusen:77
- stereotypes Verhalten (ein Zeichen stark erhöhten extrazellulären Dopamins); ebenso stark wie 20 mg/kg MPH
- extrazelluläres Dopamin erhöht
- extrazelluläres Noradrenalin erhöht
- extrazelluläres Serotonin erhöht
Serotoninfreisetzung durch Amphetamindrogen
Amphetamindrogen (MDMA, MBDB) erhöhen zugleich die Serotoninfreisetzung. Es wird vermutet, dass die amphetamininduzierte Serotoninfreisetzung nicht nur die psychomotorische Aktivierung beeinflusst, sondern darüber hinaus das subjektive Wohlbefinden (bei Einnahme als Droge auch die Euphorie) beeinflusst.88 MDBD bewirkt fast keine Dopaminfreisetzung.
Eine durch 5 mg bzw. 10 mg / kg MDMA (= 10- bis 20-fach höhere Dosierung denn als Medikament) induzierte Hyperaktivität konnte durch eine vorherige Gabe von 2,5 und 10 mg / kg des selektiven Serotoninwiederaufnahmehemmer Fluoxetin unterbunden werden. Die gleiche Wirkung hatte Fluoxetin in Bezug auf die interaktive Wirkung von MDMA und P-Chloroamphetamin.89 Dies deutet darauf hin, das MDMA Hyperaktivität durch eine Serotoninerhöhung über den Serotonintransporter verursacht, der durch Fluoxetin als Serotoninwiederaufnahmehemmer blockiert wurde.
- Es gibt Hinweise, dass eine erhöhte Serotoninausschüttung indirekt den Dopaminspiegel erhöht.89
- Andere Quellen weisen auf eine Serotonin erhöhende Wirkung von Amphetaminsalzen aufgrund Hemmung der Monoaminoxidase hin.20
- Amphetamin erhöht die c-Fos-Expression im mPFC, Striatum und Nucleus accumbens. Ein Serotonin-1A-Rezeptor-Agonist verringerte den c-Fos-Anstieg im mPFC und Striatum, nicht aber im Nucleus accumbens.90
- MPH wirkt selbst agonistisch am 5-HT1A-Rezeptor.38
2.5. Wirkung auf HPA-Achse
2.5.1. ACTH erhöht
Lisdexamfetamin und d-Amphetamin erhöhten bei Gesunden signifikant die Plasmaspiegel u.a. von:91
- ACTH
2.5.2. Corticosteroide erhöht
- D-Amphetaminmedikamente wie Lisdexamphetaminmedikamente (Elvanse) erhöhen den Cortisolspiegel, nicht jedoch den Testosteronspiegel.91
- Erhöht wurden
- Glucocorticoide (wie durch Methylphenidat; noch stärker war die Erhöhung durch die Drogen MDMA oder LSD)
- Cortisol
- Cortison
- Corticosterone
- 11-Dehydrocorticosteron,
- 11-Deoxycortisol
- Glucocorticoide (wie durch Methylphenidat; noch stärker war die Erhöhung durch die Drogen MDMA oder LSD)
- Unverändert blieben
- Mineralocorticoide
- Aldosteron
- 11-Deoxycorticosteron
- Mineralocorticoide
Die Erhöhung des Cortisolspiegels bewirkt eine stärkere Adressierung des Glucocorticoidrezeptors (GR) durch Cortisol. Cortisol bewirkt über GR die Wiederabschaltung der HPA-Achse am Ende der Stressreaktion.
Bei ADHS-HI und ADHS-C (beide mit Hyperaktivität) ist aufgrund der abgeflachten endokrinen Stressantwort der Nebenniere anzunehmen, dass die GR nicht ausreichend adressiert werden, um die HPA-Achse nach einer Stressreaktion wieder abzuschalten. Zudem besteht bei ADHS-HI (anders als bei ADHS-I) häufig eine mangelhafte GR-Funktion, die eine HPA-Achsen-Abschaltung zusätzlich erschwert.
Mehr hierzu bei Medikamente für ADHS unter ⇒ Dexamethason bei ADHS. Wird nun durch AMP die Cortisolausschüttung erhöht, könnte dies bei ADHS-HI die Wiederabschaltung der HPA-Achse verbessern. Da AMP jedoch auch bei ADHS-I wirkt, dürfte der primäre Wirkmechanismus anders sein.
2.5.3. Steroidhormone erhöht
Lisdexamfetamin und d-Amphetamin erhöhten bei Gesunden signifikant die Plasmaspiegel u.a. von:91
- Androgenen
- Dehydroepiandrosteron
- Dehydroepiandrosteronsulfat
- Androstendion (Δ4-Androsten-3,17-dion)
- Progesteron (nur bei Männern)
Unverändert blieb das Androgen
- Testosteron
Da Aggression mit einem erhöhten Testosteron zu Cortisol-Verhältnis korreliert, wirken Amphetaminmedikamente aufgrund der relativen Erhöhung des Cortisolspiegels aggressionshemmend.
Mehr hierzu unter ⇒ Neurophysiologische Korrelate von Aggression
Eine Studie an jugendlichen Rhesusaffen fand als Folge einer 12-monatigen AMP- oder MPH-Gabe in Medikamentendosierung, dass beide Wirkstoffe den Testosteronspiegel erhöhten, MPH noch deutlicher als AMP.92 Eine andere Studie an Rhesusaffen fand verringerte Testosteronspiegel bei MPH-Gabe.93
An Nagetieren wurde eine Verringerung des Testosteronspiegels durch Amphetamingabe beobachtet.9495
2.6. Inhibition von OCT2
Grundlegend zu Uptake-2-Transportern unter Dopaminabbau durch Organische Kationentransporter (OCT) im Beitrag Dopaminwiederaufnahme, Dopaminabbau
Der Organische Kationentransporter 2 (OCT2) wirkt am Abbau von Dopamin mit. OCT nehmen Dopamin und Noradrenalin sowie Serotonin und etwas stärker noch Histamin in Gliazellen auf, wo sie durch COMT abgebaut werden. OCT2 und OCT3 sitzen zudem auf (auch dopaminergen) Neuronen.
Während Methylphenidat lediglich an OCT1 (IC50: 0,36) und weder an OCT2, OCT3 oder PMAT bindet96, wirkt d-Amphetamin als hochwirksamer hOCT2-Wiederaufnahmehemmer (Ki: 10,5 mM) und moderat wirksamer hOCT1-Wiederaufnahmehemmer (Ki: 202 mM), während es mit hOCT3 erst ab 100 μM interagierte (Ki: 460 mM) (hOCT: humaner OCT).9697
d-Amphetamin bindet ungefähr gleich stark an hOCT2 und hOCT3 und an diese um eine Größenordnung (Faktor 10) schwächer als an DAT.97
Die Bindung von Amphetamin an OCT könnte zu zellulären und verhaltensbezogenen Wirkungen von Amphetamin beitragen.97
OCT2-Wiederaufnahmehemmer wirken antidepressiv.98 ZUdem wirken bei OCT2-KO-Mäusen bereits sehr viel geringer Dosen von Venlafaxin oder Reboxetin antidepressiv als bei Wildtyp-Mäusen.99
Wir halten es für überlegenswert, ob dieser Ansatz nicht auch die Wirkung von Dopaminwiederaufnahmehemmern bei ADHS unterstützen könnte.
Zudem könnten diese Zusammenhänge erklären, warum AMP, das auch als OCT2-Inhibitor wirkt, eine bessere antidepressive Wirkung zeigt als MPH, das nur an OCT1 bindet.
2.7. Sonstige Wirkungsweise auf Gehirnfunktionen
- D-Amphetamin erhöht den Metabolismus im rechten Nucleus caudatus und vermindert ihn in der rechten Rolandi-Region sowie in rechts in anterioren inferioren frontalen Regionen.100
- D-Amphetamin (wie auch L-Dopa, welches allerdings bei ADHS keinerlei Wirkungen hat, obwohl es dopaminerg wirkt) ist auch nach Schlaganfällen geeignet, die Hirnfunktionen wieder herzustellen, jedoch nur, wenn zugleich geeignete Trainingsmaßnahmen erfolgen.101 D-Amphetamin erhöht Dopamin, das neurotroph wirkt (die Neuroplastizität fördert). Dopaminerge Medikamente wie (D-)Amphetamin-Medikamente oder auch MPH können dadurch auch bei ADHS entsprechende Trainingsmaßnahmen (z.B. Neurofeedback, kognitive Verhaltenstherapie) unterstützen, indem sie die Einschränkungen der Lernfähigkeit verringern.
- Methylphenidat und Amphetaminmedikamente erhöhen die Power von Alpha (bei Ratten), währende Atomoxetin und Guanfacin dies nicht tun.102
- Lisdexamfetamin (Elvanse) bewirkt103
- erhöhten Acetylcholinspiegel im Cortex
- erhöhten Histaminspiegel im Cortex und Hippocampus (was parallel gegebenes Escitalopram nur im Hippocampus verhindert)
Amphetaminmedikamente sind damit nicht nur ein Ersatzmittel für Methylphenidat, sondern haben einen eigenen Anwendungsbereich.
2.8. Überblick zu AMP und Neurotransmittern
2.8.1. Bindungsaffinität von AMP, MPH, ATX an DAT / NET / SERT
Die Wirkstoffe Methylphenidat (MPH), d-Amphetamin (d-AMP), l-Amphetamin (l-AMP) und Atomoxetin (ATX) binden mit unterschiedlicher Affinität an Dopamintransporter (DAT), Noradrenalintransporter (NET) und Serotonintransporter (SERT). Die Bindung bewirkt eine Hemmung der Aktivität der jeweiligen Transporter.104
Die in der folgenden Tabelle genannten Werte von Easton et al. beziehen sich auf Werte im Synaptosom sowie auf den DAT im Striatum und den NET im PFC.
| Bindungsaffinität: stärker bei kleinerer Zahl (KD = Ki) | DAT | NET | SERT |
|---|---|---|---|
| MPH | 34 - 200104, 34133 | 23833, 339104 | > 10.000104 |
| d-AMP (Elvanse, Attentin) | 34 - 41104, 206 (Sulfat) 33 | 23,3 - 38,9104, 54,8 (Sulfat)33 | 3.830 - 11.000104 |
| l-AMP | 138104, 1435 (Sulfat) 33 | 30,1104, 259 (Sulfat)33 | 57.000104 |
| ATX | 1451 - 1600104 235533 | 2,6 - 5104, 20,633 | 48 - 77104 |
| GBR-12909 | 40,233 | ||
| Desipramin | 4,933 |
2.8.2. Wirkung von AMP, MPH, ATX auf Dopamin / Noradrenalin je Gehirnregion
Die Wirkstoffe Methylphenidat (MPH), Amphetamin (AMP) und Atomoxetin (ATX) verändern extrazelluläres Dopamin (DA) und Noradrenalin (NE) in verschiedenen Gehirnregionen unterschiedlich stark. Tabelle basierend auf Madras,104 modifiziert.
| PFC | Striatum | Nucleus accumbens | |
|---|---|---|---|
| MPH | DA + NE (+) |
DA + NE +/- 0 |
DA + NE +/- 0 |
| AMP | DA + NE + |
DA + NE +/- 0 |
DA + NE +/- 0 |
| ATX | DA + NE + |
DA +/- 0 NE +/- 0 |
DA +/- 0 NE +/- 0 |
3. Wirkung von Amphetaminmedikamenten im Vergleich zu MPH / Atomoxetin
Bei MPH-Nonrespondern wurde in einer randomisierten Doppelblindstudie mit n = 200 Probanden Lisdexamfetamin (EU: Elvanse) und Atomoxetin verglichen. Lisdexamfetamin wirkte in 2 von 6 Kategorien und in der Gesamtbeurteilung signifikant besser als Atomoxetin.105
Lisdexamfetamin (EU: Elvanse) wirkte in einer Doppelblindstudie zudem gut auf komorbid bestehende Depressionssymptome.106 Von MPH sind keine positiven Wirkungen auf Depressionssymptome bekannt.
Eine 2 Jahre andauernde Untersuchung bei Kindern und Jugendlichen (n = 314) ergab eine Responder-Rate zwischen 70 und 77 % bei guter Wirksamkeit und überschaubaren Nebenwirkungen.107
4. Wirkung auf ADHS-Symptome
Bei ADHS-Betroffenen, die auf D-Amphetaminmedikamente wie auf MPH positiv ansprechen, ist die Wirkung von D-Amphetaminmedikamenten zu MPH mindestens ebenbürtig108, nach unserer Erfahrung bei Erwachsenen sogar signifikant besser.
Zum Vergleich der Wirksamkeit einzelner Medikamente und Behandlungsformen siehe ⇒ Effektstärke verschiedener Behandlungsformen von ADHS.
Amphetaminmedikamente sind nach dem aktuellen europäischen Konsensus das ADHS-Mittel erster Wahl bei Erwachsenen (vor Methylphenidat), und bei Kindern das Mittel zweiter Wahl (nach Methylphenidat).67
Amphetamin-Medikamente sollten außerdem stets dann versucht werden, wenn MPH nicht wirkt (Nonresponder).
4.1. ADHS-I (ohne Hyperaktivität)
MPH wirkt bei den meisten ADHS-Betroffenen stärker aktivierend und antriebssteigernd als AMP-Medikamente. Entgegenstehende Berichte109 decken sich nicht mit unserer Erfahrung.
Darstellungen in der Fachliteratur, wonach Amphetaminmedikamente für ADHS-I-Betroffene besser geeignet seien als MPH, unter anderem, weil ADHS-I-Betroffene überdurchschnittlich häufig AMP-Nonresponder seien,110 können wir aus unserer Erfahrung ebenfalls nicht bestätigen.
Wir kennen etliche ADHS-HI-Betroffene, denen Amphetaminmedikamente deutlich besser helfen als MPH und ADHS-I-Betroffene, die mit MPH besser zurechtkommen. Eine subtypenspezifische Wirkung von Amphetaminmedikamenten oder Methylphenidat können wir nach unserer Wahrnehmung nicht feststellen. Amphetaminmedikamente wirken nach unserer Erfahrung bei ADHS-HI ebenso gut wie bei ADHS-I.
4.2. Aufmerksamkeitssteuerung
ADHS-Betroffene haben ein verringerte extrinsische und intrinsische Motivierbarkeit. Sie benötigen z.B. höhere Belohnungen, um für etwas genauso motiviert zu sein wie Nichtbetroffene. Ist die Motivation bei ADHS-Betroffenen jedoch geweckt, sind die Aufmerksamkeit und ihre Steuerbarkeit von der Nichtbetroffener nicht mehr zuverlässig zu unterscheiden. ⇒ Motivationsverschiebung in Richtung eigener Bedürfnisse erklärt Regulationsprobleme
Aufmerksamkeit korreliert u.a. mit einer Deaktivierung des Default Mode Networks (DMN). Stimulanzien sind in der Lage, die Aufmerksamkeitssteuerung von ADHS-Betroffenen (oder die Motivierbarkeit, woraus die Aufmerksamkeit folgt) der von Nichtbetroffenen anzugleichen, was sich dann auch an einer Normalisierung der DMN-Deaktivierbarkeit zeigt.111
Mehr zur abweichenden Funktion des DMN bei ADHS und dessen Normalisierung durch Stimulanzien samt weiterer Quellenangaben unter ⇒ DMN (Default Mode Network) im Beitrag ⇒ Neurophysiologische Korrelate von Hyperaktivität.
Die angegebenen Fundstellen beziehen sich auf die Wirkung von Methylphenidat. Es ist jedoch anzunehmen, dass die Wirkung durch Stimulanzien allgemein erzielt wird.
Betroffene berichten, dass MPH eine höhere Fokussierung ermögliche, während Amphetaminmedikamente (Elvanse) eher eine entspannte allgemeine Aufmerksamkeit schaffen und insgesamt etwas angenehmer wirken.
4.3. Komorbide Depression oder Dysthymie
Amphetaminmedikamente wirken wohl auch leicht serotonerg und haben damit bei komorbider Dysthymie oder Depression ein besonderes Einsatzgebiet, insbesondere da Serotoninwiederaufnahmehemmer (SSRI) bei ADHS (insbesondere bei ADHS-I) nachteilige Wirkungen haben können (siehe dort).
In Foren berichten etliche Betroffene von einer signifikanten antidepressiven Wirkung von Amphetaminmedikamenten, die sie von MPH nicht kennen.112 Dies deckt sich mit den Erfahrungen der uns bekannten Anwender.
Da Amphetamine stärker antriebssteigernd wirken können als MPH, kann dies eine bestehende suizidale Tendenz freisetzen, die bisher aufgrund der bestehenden Depression nicht ausgeführt wurde. Amphetaminmedikamente sollten daher bei (auch verdeckter) schwerer Depression mit Vorsicht eingesetzt werden.
Achtung: eine vermeintliche Dysthymie (leichte chronische Depression) bei ADHS-Betroffenen muss sauber von dem originären ADHS-Symptom der Dysphorie bei Inaktivität abgegrenzt werden.
Mehr hierzu unter ⇒ Depression und Dysphorie bei ADHS im Abschnitt ⇒ Differentialdiagnostik bei ADHS.
4.4. Komorbide Angststörungen / Depressionen
Komorbide Angststörungen oder Depressionen können durch Stimulanzien verstärkt werden, da Angst und Stimmungen durch die dopaminerge Aktivität des ventromedialen PFC in Verbindung mit dem limbischen System reguliert werden.47
4.5. Komorbide Schlafstörungen
Amphetaminmedikamente haben eine recht lange Wirkungsdauer (bis zu 13 Stunden). Eine zu späte Einnahme (weniger als 14 Stunden vor dem zu Bett gehen) könnte damit Einschlafprobleme verursachen. Manche Betroffene berichten dagegen bei Amphetaminmedikation von einer angenehmen Müdigkeit am Abend und dass sie keine Einschlafprobleme mehr hätten.
Studien zeigen, dass Amphetaminmedikamente die Schlafqualität bei ADHS insgesamt verbessern.113114
4.6. Impulsivität
Betroffene berichteten in Foren, dass MPH besser gegen Impulsivität wirke als Elvanse (Lisdexamfetamin).115
5. Ansprechrate (Responding / Nonresponding)
Ansprechen meint hier, ob eine Wirkung auf die ADHS-Symptome festzustellen ist. Betroffene, die auf ein Medikament nicht ausreichend ansprechen, nennt man Nonresponder.
Nonresponding bedeutet nicht, keine Wirkung zu haben, sondern lediglich, dass die Wirkung unter dem in der jeweiligen Studie festgelegten Maß der Symptomverbesserung bleibt.
Eine Studie berichtet eine Responderrate von 80 % (definiert als eine Verbesserung von mehr als 30 % der ADHS-RS-IV-Werte und CGI-I-Bewertungen von stark verbessert oder sehr stark verbessert).116
Eine Zusammenfassung mehrerer Untersuchungen berichtet von 69 % Ansprechrate auf Amphetamin-Medikamente und 59 % Ansprechrate auf Methylphenidat. 87 % der Betroffenen hätten auf einen der beiden Wirkstofftypen angesprochen.12
Eine 2 Jahre andauernde Untersuchung von L-Amphetamin-Medikamenten bei Kindern und Jugendlichen (n = 314) ergab eine Responder-Rate zwischen 70 und 77 % bei guter Wirksamkeit und überschaubaren Nebenwirkungen.107
Für MPH-Nonresponder ist daher sehr zu empfehlen, eine Medikation mit Amphetamin-Medikamenten (siehe 1.2.) zu testen, und umgekehrt.
Bei Trägern des COMT Val-158-Met Gen-Polymorphismus erhöht Amphetamin die Effizienz des PFC bei Probanden mit vermutlich geringem Dopaminspiegel im PFC. Bei Trägern des COMT Met-158-Met-Polymorphismus hatte Amphetamin dagegen keinen Effekt auf die kortikale Effizienz bei niedriger bis moderater Arbeitsgedächtnislast und verursachte eine Verschlechterung bei hoher Arbeitsspeicherlast. Individuen mit dem Met-158-Met-Polymorphismus scheinen ein erhöhtes Risiko für eine nachteilige Reaktion auf Amphetamin zu haben.117
6. Keine geschlechtsspezifischen Wirkungsunterschiede
Amphetaminmedikamente scheinen keine geschlechtsspezifischen Unterschiede in der Wirkung zu zeigen.118
7. Wirkung bei niedrigen Dosen beruhigend, bei hohen Dosen aktivierend
D-Amphetamin scheint ein biphasisches Wirkprofil zu haben. Niedrige Dosierungen von 0,5 bis 1 mg / kg bei Ratten (was ca. 0,2 bis 0,6 mg / kg bei Menschen entspricht), verringern die (Hyper-)aktivität, während höhere Dosen sie erhöhen.41
8. Dosierung Amphetamin-Medikamente oder MPH
Etwa 66 % aller ADHS-Betroffenen reagieren auf MPH wie auf Amphetamin-Medikamente gleich gut.
22 % reagieren besser auf Amphetamin-Medikamente als auf MPH.
11 % reagieren besser auf MPH als auf Amphetamin-Medikamente.119
Etwa 15 % der ADHS-Betroffenen sprechen auf den Wirkstoff D-Amphetamin am besten an.120
Nach diesem Ergebnis wäre es sinnvoller, die Therapie zunächst mit Amphetamin-Medikamenten zu versuchen und erst bei Nonresponding MPH als zweite Variante zu versuchen, da ADHS-Betroffene auf Amphetamin-Medikamente etwas besser ansprechen als auf MPH.
Hochbegabte mit ADHS (hier: IQ > 120) sollen besser auf Amphetamin-Medikamente ansprechen als Minderbegabte mit ADHS.121
Eine interessante Studie erörtert die Wirksamkeit von Lisdexamfetamin.122
Es empfiehlt sich ein Einstieg mit einer sehr geringen Dosierung, die erst langsam erhöht wird. Selbst wenn die optimale Dosierung bekannt wäre, würde eine sofortige optimale Dosierung möglicherweise eine Überforderung bewirken.123 Die Symptome von ADHS entstehen durch Signalübertragungsprobleme zwischen den Gehirnnerven, weil der Neurotransmitterspiegel (Dopamin, Noradrenalin) zu gering ist. Ein optimaler Neurotransmitterspiegel behebt die Signalweitergabeprobleme. Bei einem zu hohen Neurotransmitterspiegel aufgrund Überdosierung ist die Signalübertragung ebenso gestört wie bei einem zu niedrigen Spiegel.
Dies erklärt, warum zu Beginn niedrig dosiert und dann mit Geduld so lange höher dosiert werden sollte, bis eine Symptomverschlechterung festgestellt wird.
Da bei Erwachsenen die Anzahl der Dopamintransporter gegenüber 10-Jährigen auf die Hälfte sinkt, ist ein Einstieg mit einer wesentlich geringeren Dosierung als bei Kindern angeraten.
9. Wirkungsprofil (zeitlich) / Wirkdauer
In replizierten Studien über die Wirkdauer von Amphetaminmedikamenten wiesen Kinder eine kürzere Halbwertszeit von ca. 7 Stunden auf, Erwachsene dagegen eine längere von ca. 10 bis 12 Stunden.124
Der zeitliche Verlauf der Wirkung (Wirkungsprofil) hängt weniger von den Wirkstoffen als von der konkreten Medikamentenzusammensetzung ab.
Elvanse hat ein zeitlich sehr gestrecktes Wirkprofil ohne ausgeprägte Spitzen, sodass kaum Anflutungs- oder Reboundeffekte spürbar sind. Siehe: Grafische Darstellung des Elvanse-Wirkprofils. Die aus der Patentanmeldung von Shire stammende Grafik bezieht sich jedoch auf den Plasmaspiegel bei Ratten bei einer extrem hohen Dosis von 3 mg / kg.
Eine weitere Grafik zeigt die Wirkstoffverläufe bei 30 mg, 50 mg und 70 mg Elvanse, dort Seite 20.
Offen ist, inwieweit bei Lisdexamfetamin die Bindung des D-Amphetamins an Lysin wirklich zu einer abgeflachteren und verlängerten Konzentration von Amphetamin im Blutplasma führt. Eine Einmalgabe von (über den medizinisch sinnvollen Dosen liegenden) 40 mg D-Amphetamin oder 100 mg Lisdexamfetamin an gesunden Menschen zeigte keine relevanten Unterschiede der Amphetaminblutplasmakonzentration.125 Weiter weisen die Studiendaten wohl einen subjektiven Eindruck einer sanfteren und längeren Wirkung von Lisdexamfetamin seitens der Probanden aus, was die Autoren jedoch nicht wiedergeben. Eine weitere Einschränkung der Studie ist, dass die Probanden mit einer Einmalgabe behandelt wurden und keine Eindosierung an die getestete Dosierung erfolgte. Die Autoren zitieren selbst Studien, dass Amphetaminmedikamente Eingewöhnungsphasen benötigen bzw. (anfängliche) Gewöhnungseffekte zeigen. Die Ergebnisse der Studie sind daher vornehmlich pharmakologisch interessant, jedoch für die Praxis nur bedingt hilfreich.
Empirisch berichten Erwachsene recht einstimmig von einer sanfteren und verlängerten Wirkung von Lisdexamfetamin. Die Mehrheit nennt als Wirkdauer einer Einzeldosis 5 bis 7 Stunden. Ebenfalls recht einstimmig wird von einem sehr verlangsamten Wirkeintritt berichtet, wobei meist 1 bis 2 Stunden genannt werden.
Eine interne (und nicht repräsentative) Umfrage im adhs-forum.adx.org zur Wirkdauer von Elvanse (n= 80) sowie eine weitere Umfrage in einem Sub-Reddit zu Elvanse (n = 467) ergab folgendes Ergebnis (n = 547):
| Wirkdauer einer Einzeldosis Elvanse | % der Teilnehmer |
|---|---|
| 5 Stunden und weniger | 40,8 % |
| 6 bis 7 Stunden | 26,7 % |
| 8 bis 9 Stunden | 15,4 % |
| 10 bis 11 Stunden | 11 % |
| 12 Stunden und mehr | 6,2 % |
Die Umfragen sind nicht repräsentativ (keine Berücksichtigung von Alter, Gewicht, Dosishöhe oder Geschlecht), zeigen jedoch deutlich, dass eine Wirkdauer von 13 oder 14 Stunden, wie sie vom Hersteller angegeben wird, bei Erwachsenen in der Praxis allenfalls ausnahmsweise erreicht wird.
Eine detailliertere Umfrage zur Einzeldosiswirkdauer aller ADHS-Medikamente, die auch die genannten Nebenfaktoren einbezieht, läuft seit März 2023 und könnte im Herbst 2023 erste Ergebnisse zeigen.
Etliche Betroffene (wir kennen aus dem Forum zig Fälle) nehmen 2 oder 3 Elvanse-Einzeldosen am Tag, um die benötigte Ganztagesabdeckung zu erreichen, auch wenn dies nicht den Herstellervorgaben entspricht. Die individuell verkürzte Wirkzeit könnte auch Folge einer niedrigen Dosierung von oft 30 mg und weniger je Einzeldosis sein, die gewählt wurde, wenn bei einer höheren Einzeldosis in der Phase des hohen D-AMP-Blutplasmaspiegels eine Überdosierung wahrgenommen wurde. Bei fast keinem Betroffenen überschreitet die Summe der Einzeldosen 70 mg / Tag.
Das Ergebnis einer Mehrfacheinnahme kleinerer Elvanse-Dosen auf den D-AMP-Blutplasmaspiegel könnte (rein hypothetisch) so aussehen:
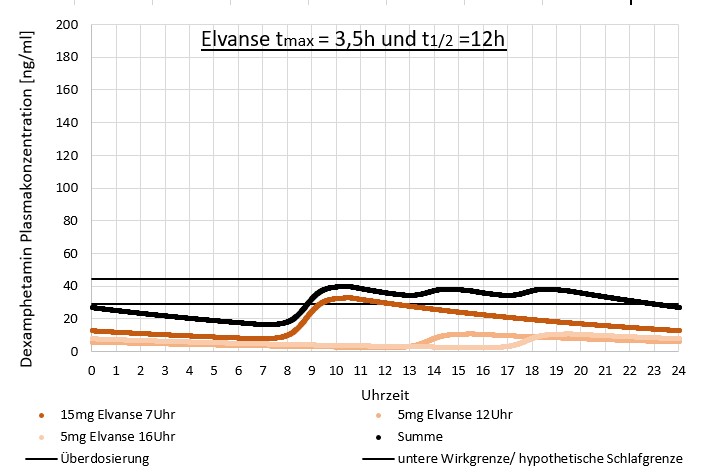
10. Anwendungsbereiche von Amphetaminmedikamenten im Verhältnis zu MPH
Amphetaminmedikamente sind nach dem aktuellen europäischen Konsensus zur Diagnose und Behandlung von ADHS bei Erwachsenen das ADHS-Mittel erster Wahl bei Erwachsenen (vor Methylphenidat), und bei Kindern das Mittel zweiter Wahl (nach Methylphenidat)67
Bei Kindern, die MPH-Nonresponder sind, die also auf MPH nicht ansprechen, ist die Wirksamkeit von Amphetaminmedikamenten zu testen.
Betroffene mit ausgeprägter Dysphorie bei Inaktivität oder mit komorbider Depression profitieren von Amphetaminmedikamenten besonders.
Daneben können Betroffene, die eine stärkere Aktivierung benötigen, mit Amphetaminmedikamenten möglicherweise besser zurechtkommen.
Hochbegabte sollen auf Amphetaminmedikamente besser ansprechen als auf MPH.121
11. Nebenwirkungen
11.1. Keine Leberschäden bei üblicher Medikamentendosierung
Hohe Dosen von Amphetaminen können mit Leberschäden und bestimmten Formen klinisch offensichtlicher Leberschäden verbunden sein. Dies wird am häufigsten bei Methylendioxymetamphetamin (MDMA: „Ecstasy“) berichtet.126
Amphetamin-Medikamente werden dagegen so niedrig dosiert, dass dies nicht eintritt: die Dosis macht das Gift. Siehe hierzu auch unter ⇒ Amphetamin-Medikamente versus Amphetamin als Droge.
11.2. AMP erhöht Histamin
AMP erhöht Histamin,127128 wie alle anderen bekannten ADHS-Medikamente auch:
- Atomoxetin
- Methylphenidat
- Modafinil
- Nikotin
- Koffein
Daher haben Menschen mit Histaminintoleranz häufig Probleme durch Einnahme von ADHS-Medikamenten.
Eine ADHS-Betroffene mit Histaminintoleranz berichtete, dass sie AMP und retardiertes MPH gar nicht vertrug, unretardiertes MPH in geringen Dosen jedoch tolerieren konnte.
11.3. Keine erhöhten kardiovaskuläre Risiken
Mehrere große Studien fanden für Amphetaminmedikamente keinerlei erhöhte Risiken schwerwiegender kardiovaskulärer Vorfälle wie Schlaganfall, Herzinfarkt oder Herzrhythmusstörungen.129130
Eine Studie über 14 Jahre fand eine Erhöhung des Risikos für kardiovaskuläre Probleme um 4 % je Jahr der Einnahme von Stimulanzien (Methylphenidat, Amphetaminmedikamente) sowie, etwas schwächer, beim Nichtstimulanz Atomoxetin.131
Eine tägliche Einnahme von Amphetaminmedikamenten bewirkte laut einer Metastudie:132
- systolischer Blutdruck erhöht um 1,93 mmHg (k = 56 RCT, n = 10.583)
- diastolischer Blutdruck erhöht um 1,84 mmHg (k = 56 RCT, n = 10.583)
- Herzfrequenz erhöht um 3,71 Schläge pro Minute (k = 47 RCT, n = 10.075)
11.4. Einzelfälle von Trichotillomanie
Es wurden Einzelfälle von Trichotillomanie (Haare ausreißen) berichtet.133 Trichotillomanie ist eine spezifische Form einer Impulskontrollstörung.
11.5. Erektion, Libido, Fortpflanzung
Der Beipackzettel von Elvanse nennt Erektile Dysfunktion bei 1 bis 10 von 100 Männern. Die Fachliteratur oder Studien berichten jedoch keine sexuellen Beeinträchtigungen durch Amphetaminmedikamente.
Berichte aus dem ADxS-ADHS-Forum berichten zuweilen Erektionsprobleme bei Amphetaminmedikamenten, kaum jedoch bei MPH.
Zwei männliche Betroffene berichteten uns von einer Sensitivitätseinbuße im Genitalbereich nach dem Konsum von Rotwein außerhalb der Wirkzeit des regelmäßig eingenommenen Elvanse. Bei einem der Betroffenen ist geringer Nikotinkonsum außerhalb der Wirkzeit ein weiteres Verdachtsmoment.
Ein Einzelfallbericht dokumentiert eine Verringerung von Testosteron und anderen Sexualhormonen sowie eine Verringerung der Spermienanzahl durch ein Amphetaminmedikament, was durch ein Zurückwechseln auf MPH behoben wurde.134
Amphetaminmedikamente binden auch an Alpha1-Adrenozeptoren (siehe oben).
Eine Blockade von Alpha1-Adrenozeptoren führt zu einer verzögerten Detumeszenz der Schwellkörper und damit zu einer verminderten Ejakulations- und Orgasmusfähigkeit, sowohl bei Frauen als auch bei Männern.135 Eine Blockade ist das Gegenteil einer Bindung. Dopamin-Agonisten wie L-Dopa oder Bromocriptin bewirken eine Steigerung des sexuellen Verlangens und der sexuellen Aktivität.
Amphetamine (in der Regel bei Drogenkonsum) können die Spermatogenese verändern und zu oxidativem Stress und anschließender Apoptose im Hodengewebe führen.136
Amphetamin in Medikamentendosis (hier: Lisdexamfetamin) veränderte den Testosteronsoiegel nicht.137
Amphetamin (in Drogendosierung) ist bei Nagetieren in der Lage, die Testosteronproduktion zu verringern und die Bildung von zyklischem AMP in den Hoden zu erhöhen.136
Eine einzige intravenöse Amphetamininjektion (Gabe als Droge) verringerte die hCG-stimulierte Testosteronfreisetzung. Der LH-Plasma-Spiegel blieb unverändert.
Amphetamin scheint somit direkt und dosisabhängig auf Leydig-Zellen zu wirken, wo es über eine Aktivierung der Adenylatzyklase die Testosteronproduktion hemmt.94
Eine einmalige intraperitoneale Methamphetamin-Gabe senkte zunächst das Serumtestosteron und steigerte es nach 48 Stunden auf ein Niveau über dem Ausgangswert.138
Chronische hohen Methamphetamin-Gabe verringerte Testosteron139 und erhöhte GABA im Hoden.140 GABA ist an der Proliferation der Leydig-Zellen und der Testosteronproduktion beteiligt.
MDMA hemmt die Hypothalamus-Hypophysen-Gonaden-Achse bei männlichen Ratten. Akuter wie chronische MDMA-Gabe bewirkte verringertes Seroumtestosteron und verringerte GnRH-mRNA-Expression. LH, Progesteron und Östradiol blieben unverändert. Dies deute auf einen verminderten Antrieb durch hypothalamische GnRH-Neuronen als Ursache für die Hemmung der Hypothalamus-Hypophysen-Gonaden-Achse hin.141
Eine subkutane MDMA-Gabe 12 Wochen lang an drei aufeinanderfolgenden Tagen / Woche (was menschlichen Wochenendkonsum simulierte) veränderte die Hormone der Hypothalamus-Hypophysen-Gonaden-Achse nicht.142
Methamphetamin kann Apoptose in Hodenkeimzellen von Mäusen auslösen143144 und die Spermienzahl verringern.145
Ratten, die 7 und 14 Tage lang intraperitoneal 5 ml/kg Methamphetamin erhielten (Drogendosis), zeigten eine signifikant verringerte Anzahl der Spermatogonien, der primären und sekundären Spermatozyten sowie der Spermatogenese-Indizes (Tubulusdifferenzierungsindex, Spermiogenese-Index, Repopulationsindex und mittlerer Durchmesser der Hodentubuli).146
MDMA ist ebenfalls in der Lage, histologische Veränderungen im Hoden von Ratten hervorzurufen und dosisabhängig DNA-Schäden an den Spermien zu verursachen. Dabei stieg jedoch die Spermienanzahl und die Spermatidenanzahl verringerte sich.142 MDMA erhöhte die Körpertemperatur und der Immunreaktivität des Hitzeschockproteins 70 (HSP70), was die Apoptose im Hodengewebe der Ratte aktivieren könnte.147
Eine Pilotstudie an Männern mit sexuellen Problemen berichtet von Verbesserungen des subjektiven sexuellen Erlebens (verringerte Dauer bis zum Orgasmus oder eine erhöhte Orgasmushäufigkeit) durch 5 bis 20 mg Amphetaminsalze (Adderall) 1 bis 4 Stunden vor der sexuellen Aktivität (bis 10 Gaben / Monat).148
In 5 Einzelfällen wurde die Behebung einer durch SSRI hervorgerufenen sexuellen Dysfunktion durch geringe Gaben von Dextroamphetamin oder Methylphenidat berichtet.149 Weitere Casestudys berichten von multiplen Erektionen (15-jähriger), hypersexuellem Verhalten (8-jähriger) durch OROS-MPH (Concerta)150 und Priapismus (14-jähriger).151
Eine Studie berichtet eine verdoppelte Rate von Testosteronmangel bei erwachsenen ADHS-Betroffenen nach 5 Jahren Stimulanzieneinnahme (1,2 %) gegenüber ADHS-Betroffenen ohne Stimulanzieneinnahme (0,67 %) oder Nichtbetroffenen (0,68 %).152
11.6. Amphetaminmedikamemte bei Senioren
Es gibt nur wenige Studien zur Wirkung und Sicherheit von Amphetaminmedikamenten bei älteren Menschen.
Eine Studie fand keine erhöhten Risiken für Lisdexamfetamin bei Menschen zwischen 55 und 84 Jahren. Es fanden sich keine altersabhängigen Trends bei Puls- oder Blutdruckveränderungen und das Sicherheitsprofil von LDX war identisch zu den Beobachtungen bei jüngeren erwachsenen Studienteilnehmern. Die Clearance von LDX ließ mit dem Alter nach, sodass niedriger Dosierung sinnvoll bzw. ein verlängerte Wirkung zu erwarten ist.153
Dies deckt sich mit den uns bekannten Erfahrungen in Bezug auf Stimulanzien bei älteren Menschen mit ADHS. Eine besonders sorgfältige Beobachtung der Entwicklung des Blutdrucks ist gleichwohl empfehlenswert.
11.7. Sonstiges
Häufige Nebenwirkungen von Amphetamin-Mischsalzen sind:35
- Appetitlosigkeit
- Stimmungsschwankungen
Seltene schwerwiegende Nebenwirkungen von Amphetamin-Mischsalzen sind:35
- psychotische Symptome
- Krampfanfälle
- Missbrauchsgefahr
Die Droge MDMA kann (anders als Amphetamin-Medikamente) Nervenzellen schädigen und die Blut-Hirn-Schranke angreifen.154
11.8. Überdosierung
Symptome einer (starken) Überdosierung von Amphetaminen (im Sinne einer Vergiftung) sind unter anderem:
- Agitation155
- Hyperaktivität156
- Bewegungsstörungen155
- Tremor155
- Hyperthermie156
- Tachykardie (Herzrasen)156
- Tachypnoe (erhöhte Atemfrequenz)156
- Mydriasis (Pupillenvergrößerung)156155
- Zittern156
- Krampfanfälle156, im Extremfall bis zu epileptischen Formen155
- Hyperreflexie (überhöhte Reflexantwort)155
- kämpferisches Verhalten155
- Verwirrung155
- Halluzinationen155
- Delirium155
- Angst155
- Paranoia155
Dass Dosen von 11,3 mg / kg LDX bei Ratten toxische Wirkungen auslösen, verwundert wenig, da dies deutlich über Medikamentendosen liegt.157
12. Abbau von Amphetamin
12.1. Abbau von LDX
Lisdexamfetamin (Elvanse) wird im Blut-Zytosol der Erythrozyten durch eine unbekannte Aminosäure (vermutlich eine Aminopeptidase)158159 zu d-AMP umgewandelt, indem die kovalente Bindung zwischen d-Amphetamin und L-Lysin gespalten wird. Erst d-AMP ist pharmakologisch wirksam. d-AMP wird über CYP2D6 abgebaut.
LDX wird zu 96 % über den Urin ausgeschieden, davon28
- 42 % der Dosis als AMP
- 25 % als Hippursäure
- 2 % als intaktes LDX.
LDX ist im Gegensatz zu AMP wenig empfindlich gegenüber Urin-pH-Wert-Veränderungen.
Die Halbwertzeit von LDX beträgt typischerweise weniger als 1 Stunde.
12.2. Abbau von D-AMP und L-AMP
D-AMP wird schneller metabolisiert als l-AMP, sodass die Exposition von d-AMP 9-11 Stunden und von l-Amp 11-14 Stunden andauert.
Eine Einnahme zusammen mit einer fettreichen Mahlzeit kann die Halbwertszeit von d-AMP um eine Stunde verlängern.
AMP wird auf zwei Wegen abgebaut:28
- Hydroxylierung durch CYP2D6 zu:160159
- 4-Hydroxyamphetamin
- Noradrenalin (Alphahydroxyamphetamin, Norepinephrin)
- beide unterliegen einem weiteren Metabolismus
- oxidative Desaminierung
Zu anderen Ergebnissen kam eine Studie, wonach CYP2D6 möglicherweise kaum am Abbau von AMP beteiligt ist.161 Auch weitere Studien deuten eher darauf hin, dass Amphetamin selbst deutlich schwächer von CYP2D6 metabolisiert wird als manche Amphetaminanaloga.162163
Gleichwohl ist Amphetamin ein starker CYP2D6-Inhibitor.163
AMP wird primär über die Nieren ausgeschieden.
Da AMP leicht basisch ist (pKA = 9,9), hängt die AMP-Ausscheidung stark vom pH-Wert des Urins und der Durchflussrate ab, wobei die Rückgewinnung von AMP im Urin zwischen 1 % und 75 % liegt und der Rest hepatisch metabolisiert wird:28
- normale Urin-pH-Werte
- 30 bis 40 % der AMP-Dosis werden weitgehend als unveränderte Ausgangsverbindung ausgeschieden
- 50 % der Dosis werden als Alpha-Hydroxyamphetamin oder sein nachgeschalteter inaktiver Metabolit, die Hippursäure, ausgeschieden.
- saurer Urin (pH <6,0)
- beschleunigte AMP-Ausscheidung
- alkalischer Urin (pH >7,5)
- verzögerte AMP-Ausscheidung
Die Halbwertszeit von AMP soll sich je Einheit des pH-Anstiegs um 7 Stunden erhöhen. Säurebildende oder alkalisierende Mittel können daher die AMP-Wirkung erheblich verändern.
12.3. Wirkdauer von AMP; Einfluss von CYP2P6-Stoffwechsel-Typen
Das CYP2D6-Gen ist stark polymorph. In Mitteleuropa relevant sind insbesondere die Allele164
- CYP2D6*3
- CYP2D6*4
- CYP2D6*5
- CYP2D6*6
- CYP2D6*9
- CYP2D6*41
Schlechte Metabolisierer dürften niedrigere AMP-Dosen benötigen und ultraschnelle Metabolisierer dürften höhere AMP-Dosen benötigen. Die Auswirkungen von CYP2D6-Polymorphismen auf den AMP-Stoffwechsel sind jedoch noch ungeklärt.28
Ausgehend von der Erfahrung mit dem Einfluss von CYP2D6 auf die Wirkung anderer Medikamenten (CYP2D6 ist für die Metabolisierung von 20 - 30 % aller Medikamente verantwortlich), führen die verschiedenen CYP2D6-Gen-Varianten zu verschiedenen Metabolisierungs-Typen:164
- Langsamverstoffwechsler - ca. 7 %
- besonders langsame Eindosierung wichtig
- besonderes geringe Dosierung hilfreich
- mäßig schnelle Verstoffwechsler - ca. 40 %
- Schnellverstoffwechsler - ca 46 %
- Ultraschnellverstoffwechsler - ca. 7 %
- CYP2D6*XN-Allel
- erhöhte Enzymaktivität
- ist mit Therapie-Resistenzen assoziiert (Non-Responder)
- erhöhte Dosis kann hilfreich sein
Mehr hierzu unter –> CYP2D6 Metabolisierungsenzym
Zwei Online-Umfragen unter zusammen rund 550 ADHS-Betroffenen, die Elvanse einnehmen, zeigte, dass rund 40 % eine Wirkdauer von 5 Stunden und weniger und zwei Drittel eine Einzeldosis-Wirkdauer von 7 Stunden und weniger haben. Mehr hierzu unter Wirkung und Wirkdauer von ADHS-Medikamenten
13. Kontraindikationen und Wechselwirkungen
Wie bei jedem hier beschriebenen Medikament gibt es auch bei Amphetamin-Medikamenten Kontraindikationen.
Vor einer Einnahme ohne vorherige ärztliche Konsultation ist zu warnen.
- Schwangerschaft / Stillzeit
- keine Nachteile für das Kind bei fortgesetzter Einnahme von D-Amp der Mutter in der Schwangerschaft. Bei Abbruch der D-Amp-Einnahme in der Schwangerschaft fand sich dagegen ein erhöhtes Risiko eines Schwangerschaftsabbruchs. Es fanden sich Vorteile, wenn vor und in der Schwangerschaft kein D-Amp eingenommen wurden. Bei Kinderwunsch könnte daher ein rechtzeitiges Absetzen hilfreich sein.165
- Eine Kohortenstudie fand kein erhöhtes Risiko für ADHS oder andere neuronale Entwicklungsstörungen durch MPH- oder AMP-Einnahme in der Schwangerschaft.166
- Risiko neuronaler Entwicklungsstörungen für den Nachwuchs bei Einnahme von ATX in der Schwangerschaft unverändert (schwedische Kohortenstudie, n = 861,650 Kinder von n = 572,731 Müttern von 2008-2017)167
- Gewicht der Neugeborenen
- unverändert, von Müttern mit ADHS, die während der Schwangerschaft Amphetaminmedikamente einnahmen.168 Dies deckt sich mit Ergebnissen von einer großen Kohortenstudie bei MPH-Einnahme in der Schwangerschaft.169
- leichte Verringerung des Geburtsgewichts sowie eine leichte Erhöhung der Risiken von Präeklampsie, Plazentaunterbrechung oder Frühgeburt bei Stimulantieneinnahme (AMP oder MPH) in der Schwangerschaft, die allerdings so gering war, dass die Autoren keine Absetzung der Stimulantieneinnahme in der Schwangerschaft empfahlen.170 Atomoxetin zeigte diese leichten Risikoerhöhungen nicht.
- Fehlgeburten
- verdoppeltes Risiko von Fehlgeburten bei der Einnahme von Stimulanzien während der Schwangerschaft.171
- Missbildungen
Für Lisdexamfetamin:174
- Überempfindlichkeit gegen den Wirkstoff
- Monoaminoxidasehemmer (MAO-Hemmer) gleichzeitig oder 14 Tage vor Einnahme
- Risiko: hypertensive Krise
- Hyperthyreose / Thyreotoxikose
- Erregungszustände
- symptomatische Herz-Kreislauf-Erkrankung
- fortgeschrittene Arteriosklerose
- mittelschwere bis schwere Hypertonie
- Glaukom
- Serotoninwiederaufnahmehemmer
- bei gleichzeitiger Gabe von SSRI und Amphetaminmedikamenten sollte das Risiko eines Serotoninsyndroms beachtet werden.20
Nach einer sehr großen Studie ist das Risiko, eine Psychose zu entwickeln, für ADHS-Betroffene, die MPH einnehmen, mit 0,10 % geringer als das derjenigen, die mit Amphetaminmedikamenten behandelt werden (0,21 %).175 Während mit Stimulanzien behandelte ADHS-Betroffene 2,4 Psychosefälle je 1000 Personenjahre haben, sind es über die Gesamtbevölkerung 0,214 %.176 Die Studien lassen keine Aussage darüber zu, ob die erhöhte Psychoseprävalenz auf ADHS oder Stimulanzien zurückzuführen ist.
13.1. Verkürzte Halbwertszeit (verringerte Wirkung)
Wirkabschwächung von Dexamphetamin durch:177
- Adrenorezeptorblocker (Betablocker)
- z.B.:
- Propranolol
- z.B.:
- Lithium
- Phenothiazine
- Haloperidol
- Stoffe, die pH-Wert im Gastrointestinaltrakt senken
- z.B:
- Guanethidin
- Reserpin
- Glutaminsäure
- Salzsäure
- Ascorbinsäure
- Fruchtsaft
- bewirken verminderte Aufnahme von Dexamphetamin
- z.B:
- Stoffe, die Urin ansäuern (Ammoniumchlorid, Natriumdihydrogenphosphat etc)
- erhöhen ionisierte Ausscheidungsprodukte von Dexamphetamin im Urin, worauf die renale Ausscheidung steig
- bei Ansäuerung des Urins (verringerter phWert)174
z.B. durch- Ascorbinsäure
- Thiaziddiuretika
- proteinreiche Ernährung
- Diabetes mellitus
Achtung: Lebensmittel, die sauer schmecken, wirken im Körper jenseits des Verdauungstrakts häufig basisch.
Beispiel: Zitronensaft hat einen pH-Wert von 2,4 und wirkt daher sauer auf Mund und Magen. Nach der Verdauung bleiben im restlichen Organismus jedoch nur eine basische Überreste, die den ph-Wert erhöhen.
Die Wirkung von Lebensmitteln nach der Verdauung auf die Säurebelastung der Niere durch Mineralstoffe und Eiweiß wird durch den PRAL-Wert (Potentielle renale Säurelast, Potential Acid Load) angegeben. Zur Beurteilung der Säurebelastung von Mund und Magen (wie sie bei Sodbrennen relevant ist) ist dieser Wert ungeeignet.
Je höher der PRAL-Wert, desto saurer die Wirkung auf die Niere und den übrigen Körper hinter den Verdauungsorganen.
Der pH-Wert des Urins hat sich als guter PRAL-Marker erwiesen. Ein alkalischer pH-Urin-Wert korreliert mit einer Ernährung mit negativem PRAL-Wert, während pH-Urin-Werte unter 6,0 mit einer säurebildenden Ernährung korreliert.
Dabei ist zwischen pflanzlichen und tierischen Proteinen zu unterscheiden. Nach 7 Tagen vegetarischer Ernährung steigt der pH-Urin-Wert an und der PRAL-Wert sinkt, ebenso bei 2 oder 3 Tagen vegetarischer Ernährung pro Woche.178 Vegetarische Ernährung korreliert damit mit einer verlängerten Amphetaminmedikamentenwirkung.
Lebensmittel mit hohem Oxalatgehalt können die Säurebildung erhöhen.179
Eine Studie gibt als Berechnungsweg aus:180 PRAL (mEq/d) = 0.49 x Protein (g/d) + 0.037 x Phosphor (mg/d) - 0.021 x Kalium (mg/d) - 0.026 x Magnesium (mg/d) - 0.013 x Calcium (mg/d).
Mit anderen Worten: Lebensmittel mit einem stark negativen PRAL-Wert bewirken einen basischen (weniger sauren) Urin und fördern damit eine verlängerte Wirkung von Amphetaminmedikamenten. Lebensmittel mit einem hohen PRAL-Wert bewirken einen sauren Urin und fördern damit eine verkürzte Wirkung von Amphetaminmedikamenten. Nach diesem Modell ist Hartkäse geeignet, die Wirkung von Amphetaminmedikamenten abzukürzen, Rosinen könnten sie verlängern.
Mehr hierzu unter Säurehaushalt und Amphetaminmedikamente im Beitrag Wirkung und Wirkdauer von ADHS-Medikamenten
13.2. Verlängerte Halbwertszeit (erhöhte Wirkung)
- bei alkalisiertem Urin (erhöhter phWert)174
z.B. durch- Natriumhydrogencarbonat (Backpulver, Soda)
- Ernährung mit hohem Obst- / Gemüseanteil
- Harnwegsinfektionen
- Erbrechen
- Clonidin177
Verstärkte Wirkung von Dexamphetamin durch:177
- Disulfiram
- Stoffe, die pH-Wert im Gastrointestinaltrakt erhöhen, steigern Dexamphetamin-Aufnahme
- z.B:
- Natriumbicarbonat (Backpulver)
- z.B:
- Stoffe, die pH-Wert des Urins erhöhen, steigern nicht ionisierten Ausscheidungsprodukte im Urin, was renale Ausscheidung verringert und so Blutspiegel von Dexamphetamin erhöht
- z.B:
- Acetazolamid
- einige Thiazide
- z.B:
Es gibt Hinweise, dass eine verringerte Expression des CACNA1C-Gens zu einer verlängerten Wirkung von Dopaminwiederaufnahmehemmern führen kann.181 Umgekehrt dürfte eine erhöhte CACNA1C-Expression zu einer verkürzten Wirkung führen.
13.3. Verzögerte Wirkung
Lisdexamfetamin (Elvanse) hat bei fettreichen Mahlzeiten einen um eine Stunde verzögerten maximalen Blutspiegel (4,7 Stunden anstatt 3,8 Stunden nach Einnahme).182 Andere Parameter, wie z.B. die Wirkungsdauer, ändern sich jedoch nicht.
13.4. Verstärkende Wirkung auf Amphetamine
13.4.1. Alkohol erhöht Amphetaminspiegel
Alkohol kann den Amphetaminspiegel erhöhen.183
13.4.2. CYP2D6-Inhibitoren erhöhen Amphetaminspiegel
Da Amphetamin durch CYP2D6 abgebaut wird, können Medikamente, die ebenfalls durch CYP2D6 abgebaut werden, den Abbau von Amphetamin sowie den eigenen Abbau verlangsamen, da eine Konkurrenz um die CYP2D6-Enzym entsteht.
CYP2D6-Inhibitoren können den Amphetaminspiegel erhöhen, sodass eine Dosisverringerung erforderlich wird. Nach dem Absetzen von CYP2D6-Inhibitoren kann eine Dosiserhöhung von Amphetaminmedikamenten erforderlich sein.183
CYP2D6-Induktoren können den Abbau beschleunigen und damit die Wirkung verringern.
Siehe hierzu unter CYP2D6 Metabolisierungsenzym
13.5. Abschwächende Wirkung auf Amphetamine
Eine abschwächende Wirkung auf Amphetamin haben:184
- Chlorpromazin
- Haloperidol
- Lithiumcarbonat
Eine einzelne Betroffene berichtete uns über einen Wirkungsverlust von Elvanse durch Dienogest 2 mg (Zafrilla) bei Endometriose, während die Wirkung von Attentin unverändert blieb.
13.6. Wenig Wechselwirkungen von AMP auf andere Medikamente
Im Gegensatz zu den genannten Wechselwirkungen auf Amphetaminmedikamente durch andere Medikamente sind kaum Wechselwirkungen von Amphetaminmedikamenten auf andere Medikamente bekannt.183
Amphetamin soll geringfügig hemmend wirken auf die Cytochrome
- CYP2D6
- CYP1A2
- CYP3A4.
Die klinische Relevanz werde als gering eingestuft.184
Abschwächende Wirkung auf184
- Antihypertensiva wie z.B. Guanethidin
Verstärkend auf184
- analgetische Wirkung von Opioiden
13.7. AMP in der Schwangerschaft
Ene kleine prospektive Studie an n = 13 Kindern, deren Mütter während der Stillzeit Amphetaminmedikamente erhilten, fand keine Nachteile für die Kinder.185
14. Langzeitwirkung: Keine Gewöhnungseffekte von Amphetaminmedikamenten
Eine Metaanalyse von 87 randomisierten placebokontrollierten doppelblinden Studien fand keine Hinweise auf ein Nachlassen der Wirkung von Methylphenidat, Amphetaminmedikamenten, Atomoxetin oder α2-Antagonisten bei längerer Einnahme.186
15. Präparate
Amphetaminmedikamente sind als verschiedene Präparate erhältlich.
-
Amphetaminmedikamente mit unverzögerter Wirkstofffreisetzung
- Attentin
- Wirkstoff: Dextroamphetamin
- Attentin
-
Amphetaminmedikamente mit verzögerter Wirkstofffreisetzung
- Lisdexamfetamin
Lisdexamfetamin ist an Lysin gebundenes Dextroamphetamin. Die Lysinbindung bewirkt eine sehr langsame und gleichmäßige Freisetzung von Dextroamphetamin im Blut und damit eine verlängerte Wirkung.- Elvanse Hartkapseln
In Europa war Elvanse bis 2024 in zwei Zulassungsformen erhältlich, die das identische Medikament enthalten
Elvanse (Zulassung für Kinder); 20, 30, 40, 50, 60, 70 mg
Elvanse adult (Zulassung für Erwachsene); 20, 30, 40, 50, 60, 70 mg. 20, 40 und 60 mg sind Stand Ende 2023 nicht lieferbar.
Kapselgrößen von 10 mg sind, anders als in den USA, nicht erhältlich.
In 2024 wurde in Deutschland die ZUlassung von Elvanse udn Elvanse adult zusammengefasst, so dass für Kinder und Erwachsene nur noch Elvansezugelassen ist. - Lisdexamfetamin Generika
- In 2024 lief das Patent für Elvanse aus. Seither sind in Deutschland verschiedene Generika auf den Markt gekommen.
- Lisdex-Aristo Hartkapseln 20, 30, 40, 50, 60, 70 mg
- Lisdex-Aristo 10 mg/ml Lösung zum Einnehmen
- Zulassung in Deutschland am 7. Mai 2024
- Gebrauchsinformation
- Fachinformation
- Elvanse Hartkapseln
- Lisdexamfetamin
-
Amphetaminsaft
In Deutschland mussten Amphetaminmedikamente lange aus Rohsubstanzen durch Apotheker hergestellt werden.2 Seit 2011 ist ein D-Amphetamin in Deutschland als Fertigmedikament erhältlich und für die Behandlung von ADHS zugelassen (Attentin), 2013 wurde ein D-Amphetamin als Lisdexamfetamin in lysingebundener Form (Elvanse) für die Behandlung von Kindern zugelassen. Seit Mai 2019 ist Elvanse Adult zur Behandlung von ADHS bei Erwachsenen zugelassen (30, 50, 70 mg). In 2023 wurden auch 20, 40, 60 mg für Erwachsene zugelassen, wobei bisher offen ist, ab wann diese auch erhältlich sein werden.
In Österreich kann Elvanse verschrieben werden, wenn andere Medikamente unwirksam sind oder Nebenwirkungen zeigen. Dies muss der Arzt gegenüber der Kasse begründen.
16. Auslandsmitnahme von Amphetaminmedikamenten
Siehe hierzu unter Auslandsmitnahme von Stimulanzien
Edel, Vollmoeller (2006): Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung bei Erwachsenen, Springer, Seite 57, Stand 2006 ↥
so noch Edel, Vollmoeller (2006): Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung bei Erwachsenen, Springer, Seite 57 ↥ ↥
Takeda März 2024: Fachinformation Elvanse 20 mg/30 mg/40 mg/50 mg/60 mg/70 mg, unter 4.1. ↥
Rösler, Retz (2020): Medikamentöse Therapie der ADHS bei Erwachsenen; Psychiatrie up2date 2020; 14: 59–75 ↥
Kooij, Bijlenga, Salerno, Jaeschke, Bitter, Balázs, Thome, Dom, Kasper, Filipe, Stes, Mohr, Leppämäki, Brugué, Bobes, Mccarthy, Richarte, Philipsen, Pehlivanidis, Niemela, Styr, Semerci, Bolea-Alamanac, Edvinsson, Baeyens, Wynchank, Sobanski, Philipsen, McNicholas, Caci, Mihailescu, Manor, Dobrescu, Krause, Fayyad, Ramos-Quiroga, Foeken, Rad, Adamou, Ohlmeier, Fitzgerald, Gill, Lensing, Mukaddes, Brudkiewicz, Gustafsson, Tania, Oswald, Carpentier, De Rossi, Delorme, Simoska, Pallanti, Young, Bejerot, Lehtonen, Kustow, Müller-Sedgwick, Hirvikoski, Pironti, Ginsberg, Félegeházy, Garcia-Portilla, Asherson (2018): Updated European Consensus Statement on diagnosis and treatment of adult ADHD, European Psychiatrie, European Psychiatry 56 (2019) 14–34, http://dx.doi.org/10.1016/j.eurpsy.2018.11.001, Seite 22, 7.4.1. ↥ ↥ ↥
Cortese, Adamo, Del Giovane, Mohr-Jensen, Hayes, Carucci, Atkinson, Tessari, Banaschewski, Coghill, Hollis, Simonoff, Zuddas, Barbui, Purgato, Steinhausen, Shokraneh, Xia, Cipriani (2018): Comparative efficacy and tolerability of medications for attention-deficit hyperactivity disorder in children, adolescents, and adults: a systematic review and network meta-analysis. Lancet Psychiatry. 2018 Sep;5(9):727-738. doi: 10.1016/S2215-0366(18)30269-4. ↥ ↥ ↥
https://www.awmf.org/uploads/tx_szleitlinien/028-045k_S3_ADHS_2018-06.pdf, S 40/81 ↥
Banaschewski T (Leitlinienkoordinator), Hohmann, Millenet et al (2018): Langfassung der interdisziplinären evidenz- und konsensbasierten (S3) Leitlinie „Aufmerksamkeitsdefizit- / Hyperaktivitätsstörung (ADHS) im Kindes-, Jugend- und Erwachsenenalter“ AWMF-Registernummer 028-045, S. 72/198 ↥
Lisdexamfetamin – jetzt auch für Erwachsene zugelassen – Kompendium psychiatrische Pharmakotherapie, Springer. ↥
Frölich, Banaschewski, Spanagel, Döpfner, Lehmkuhl (2012): Die medikamentöse Behandlung der Aufmerksamkeitsdefizit-Hyperaktivitätsstörung im Kindes- und Jugendalter mit Amphetaminpräparaten; Zeitschrift für Kinder- und Jugendpsychiatrie und Psychotherapie (2012), 40, pp. 287-300. https://doi.org/10.1024/1422-4917/a000185 ↥
Arnold: Journal of Attention Disorders Vol. 3(4):200-211 (2000) Methylphenidate vs. amphetamine: Comparative review, n = 174 ↥ ↥
Krause, Krause (2014): ADHS im Erwachsenenalter, Schattauer. Fallbeispiel S. 155 ↥
Madhoo, Keefe, Roth, Sambunaris, Wu, Trivedi, Anderson, Lasser (2014): Lisdexamfetamine dimesylate augmentation in adults with persistent executive dysfunction after partial or full remission of major depressive disorder; Neuropsychopharmacology. 2014 May;39(6):1388-98. doi: 10.1038/npp.2013.334. n=143 Erwachsene ↥
Castells X1, Ramos-Quiroga JA, Bosch R, Nogueira M, Casas (2011): Amphetamines for Attention Deficit Hyperactivity Disorder (ADHD) in adults; Cochrane Database Syst Rev. 2011 Jun 15;(6):CD007813. doi: 10.1002/14651858.CD007813.pub2. n = 1071 ↥
Childress, Komolova, Sallee (2019): An update on the pharmacokinetic considerations in the treatment of ADHD with long-acting methylphenidate and amphetamine formulations. Expert Opin Drug Metab Toxicol. 2019 Nov;15(11):937-974. doi: 10.1080/17425255.2019.1675636. PMID: 31581854. REVIEW ↥ ↥
Edel, Vollmoeller (2006): Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung bei Erwachsenen, Springer, Seite 57 ↥ ↥
Stahl (2013): Stahl’s Essential Psychopharmacology, 4. Auflage, Chapter 12: Attention deficit hyperactivity disorder and its treatment, Seite 491 ↥ ↥ ↥ ↥ ↥
Castellanos, Tannock (2002): Neuroscience of attention-deficit/hyperactivity disorder: The search for endophenotypes; Article in Nature reviews Neuroscience 3(8):617-28 · September 2002; DOI: 10.1038/nrn896, Seite 621 ↥
Davis, Hernandez, Stock (2020): Adolescent Polypharmacy and Serotonin Syndrome. Clin Neuropharmacol. 2020 Jan/Feb;43(1):28-30. doi: 10.1097/WNF.0000000000000375. PMID: 31934921. ↥ ↥ ↥
Prox-Vagedes, Ohlmeier in Ohlmeier, Roy (Hrsg.) (2012): ADHS bei Erwachsenen – Ein Leben in Extremen, Kapitel 5: Die Suche nach dem Rausch: Substanzabhängigkeit bei ADHS Seite 101, mwNw ↥
Kämmerer W (2024): Comparative pharmacology and abuse potential of oral dexamphetamine and lisdexamfetamine-A literature review. Hum Psychopharmacol. 2024 Jul 18:e2910. doi: 10.1002/hup.2910. PMID: 39024047. REVIEW ↥ ↥
Sharman J, Pennick M (2023): Lisdexamfetamine prodrug activation by peptidase-mediated hydrolysis in the cytosol of red blood cells. Neuropsychiatr Dis Treat. 2014 Nov 28;10:2275-80. doi: 10.2147/NDT.S70382. PMID: 25489246; PMCID: PMC4257105. ↥
https://www.adhspedia.de/wiki/Umrechnungstabelle_Medikamente ↥
Stutzman DL, Dopheide JA (2024): Practice Pearls for Stimulant Treatment of Attention-Deficit/Hyperactivity Disorder in Youth. J Pediatr Pharmacol Ther. 2024 Jun;29(3):215-231. doi: 10.5863/1551-6776-29.3.215. PMID: 38863854; PMCID: PMC11163912. ↥
Pharmazeutische Zeitung: Lisdexamfetamin|Elvanse®|71|2013 ↥ ↥
Childress, Komolova, Sallee (2019): An update on the pharmacokinetic considerations in the treatment of ADHD with long-acting methylphenidate and amphetamine formulations. Expert Opin Drug Metab Toxicol. 2019 Nov;15(11):937-974. doi: 10.1080/17425255.2019.1675636. PMID: 31581854. ↥ ↥ ↥ ↥ ↥
Heal DJ, Gosden J, Smith SL (2024): Stimulant prodrugs: A pharmacological and clinical assessment of their role in treating ADHD and binge-eating disorder. Adv Pharmacol. 2024;99:251-286. doi: 10.1016/bs.apha.2023.10.002. PMID: 38467483. REVIEW ↥
Medikamio.com: Elvanse Abruf 09.07.2023 ↥
Krishnan SM, Stark JG (2008): Multiple daily-dose pharmacokinetics of lisdexamfetamine dimesylate in healthy adult volunteers. Curr Med Res Opin. 2008 Jan;24(1):33-40. doi: 10.1185/030079908x242737. PMID: 18021493. ↥
Easton N, Steward C, Marshall F, Fone K, Marsden C (2007): Effects of amphetamine isomers, methylphenidate and atomoxetine on synaptosomal and synaptic vesicle accumulation and release of dopamine and noradrenaline in vitro in the rat brain. Neuropharmacology. 2007 Feb;52(2):405-14. doi: 10.1016/j.neuropharm.2006.07.035. PMID: 17020775. ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥
Huberman (2023): Adderall, Stimulants & Modafinil for ADHD: Short- & Long-Term Effects | Huberman Lab Podcast, english ↥
Buoli, Serati, Cahn (2016): Alternative pharmacological strategies for adult ADHD treatment: a systematic review. Expert Rev Neurother. 2016;16(2):131-44. doi: 10.1586/14737175.2016.1135735. PMID: 26693882. REVIEW ↥ ↥ ↥
Fouladvand, Hankosky, Bush, Chen, Dwoskin, Freeman, Henderson, Kantak, Talbert, Tao, Zhang (2019): Predicting substance use disorder using long-term attention deficit hyperactivity disorder medication records in Truven. Health Informatics J. 2019 May 19:1460458219844075. doi: 10.1177/1460458219844075. ↥
Heal, Cheetham, Smith (2009): The neuropharmacology of ADHD drugs in vivo: insights on efficacy and safety. Neuropharmacology. 2009 Dec;57(7-8):608-18. doi: 10.1016/j.neuropharm.2009.08.020. ↥ ↥ ↥ ↥ ↥ ↥ ↥
Faraone (2018): The pharmacology of amphetamine and methylphenidate: Relevance to the neurobiology of attention-deficit/hyperactivity disorder and other psychiatric comorbidities. Neurosci Biobehav Rev. 2018 Apr;87:255-270. doi: 10.1016/j.neubiorev.2018.02.001. PMID: 29428394. ↥ ↥ ↥
Visentin R, Dalla Man C, Kovatchev B, Cobelli C (2014): The university of Virginia/Padova type 1 diabetes simulator matches the glucose traces of a clinical trial. Diabetes Technol Ther. 2014 Jul;16(7):428-34. doi: 10.1089/dia.2013.0377. PMID: 24571584; PMCID: PMC4074748. ↥
Gutiérrez-Casares JR, Quintero J, Segú-Vergés C, Rodríguez Monterde P, Pozo-Rubio T, Coma M, Montoto C (2023): In silico clinical trial evaluating lisdexamfetamine’s and methylphenidate’s mechanism of action computational models in an attention-deficit/hyperactivity disorder virtual patients’ population. Front Psychiatry. 2023 Jun 2;14:939650. doi: 10.3389/fpsyt.2023.939650. PMID: 37333910; PMCID: PMC10273406. ↥
Seeman P, Madras BK (1998): Anti-hyperactivity medication: methylphenidate and amphetamine. Mol Psychiatry. 1998 Sep;3(5):386-96. doi: 10.1038/sj.mp.4000421. PMID: 9774771. REVIEW ↥ ↥ ↥ ↥ ↥ ↥
Covey DP, Juliano SA, Garris PA (2013): Amphetamine elicits opposing actions on readily releasable and reserve pools for dopamine. PLoS One. 2013 May 3;8(5):e60763. doi: 10.1371/journal.pone.0060763. PMID: 23671560; PMCID: PMC3643976. ↥ ↥ ↥
Schmitz Y, Lee CJ, Schmauss C, Gonon F, Sulzer D (2001): Amphetamine distorts stimulation-dependent dopamine overflow: effects on D2 autoreceptors, transporters, and synaptic vesicle stores. J Neurosci. 2001 Aug 15;21(16):5916-24. doi: 10.1523/JNEUROSCI.21-16-05916.2001. PMID: 11487614; PMCID: PMC6763160. ↥ ↥
Sulzer D, Rayport S (1990): Amphetamine and other psychostimulants reduce pH gradients in midbrain dopaminergic neurons and chromaffin granules: a mechanism of action. Neuron. 1990 Dec;5(6):797-808. doi: 10.1016/0896-6273(90)90339-h. PMID: 2268433. ↥ ↥
Schmitz Y, Schmauss C, Sulzer D. Altered dopamine release and uptake kinetics in mice lacking D2 receptors. J Neurosci. 2002 Sep 15;22(18):8002-9. doi: 10.1523/JNEUROSCI.22-18-08002.2002. PMID: 12223553; PMCID: PMC6758092. ↥ ↥ ↥
Frölich, Banaschewski, Spanagel, Döpfner, Lehmkuhl (2012): Die medikamentöse Behandlung der Aufmerksamkeitsdefizit-Hyperaktivitätsstörung im Kindes- und Jugendalter mit Amphetaminpräparaten; Zeitschrift für Kinder- und Jugendpsychiatrie und Psychotherapie (2012), 40, pp. 287-300. https://doi.org/10.1024/1422-4917/a000185 ↥ ↥ ↥
Stahl (2013): Stahl’s Essential Psychopharmacology, 4. Auflage, Chapter 12: Attention deficit hyperactivity disorder and its treatment, Seite 490 ↥ ↥ ↥ ↥ ↥
Steinhausen, Rothenberger, Döpfner (2010): Handbuch ADHS, Seite 84, 85 ↥ ↥ ↥
Castellanos, Tannock (2002): Neuroscience of attention-deficit/hyperactivity disorder: The search for endophenotypes; Article in Nature reviews Neuroscience 3(8):617-28 · September 2002; DOI: 10.1038/nrn896, Seite 621, mwNw ↥ ↥
Khoshbouei H, Sen N, Guptaroy B, Johnson L’, Lund D, Gnegy ME, Galli A, Javitch JA (2004): N-terminal phosphorylation of the dopamine transporter is required for amphetamine-induced efflux. PLoS Biol. 2004 Mar;2(3):E78. doi: 10.1371/journal.pbio.0020078. PMID: 15024426; PMCID: PMC368172. ↥ ↥ ↥
Daniels GM, Amara SG (1999):. Regulated trafficking of the human dopamine transporter. Clathrin-mediated internalization and lysosomal degradation in response to phorbol esters. J Biol Chem. 1999 Dec 10;274(50):35794-801. doi: 10.1074/jbc.274.50.35794. PMID: 10585462. ↥
Granas C, Ferrer J, Loland CJ, Javitch JA, Gether U (2003): N-terminal truncation of the dopamine transporter abolishes phorbol ester- and substance P receptor-stimulated phosphorylation without impairing transporter internalization. J Biol Chem. 2003 Feb 14;278(7):4990-5000. doi: 10.1074/jbc.M205058200. PMID: 12464618. ↥
Giambalvo CT (2003): Differential effects of amphetamine transport vs. dopamine reverse transport on particulate PKC activity in striatal synaptoneurosomes. Synapse. 2003 Aug;49(2):125-33. doi: 10.1002/syn.10223. PMID: 12740868. ↥
Foster JD, Pananusorn B, Vaughan RA (2002): Dopamine transporters are phosphorylated on N-terminal serines in rat striatum. J Biol Chem. 2002 Jul 12;277(28):25178-86. doi: 10.1074/jbc.M200294200. PMID: 11994276. ↥
Mulvihill (2019): Presynaptic regulation of dopamine release: Role of the DAT and VMAT2 transporters. Neurochem Int. 2019 Jan;122:94-105. doi: 10.1016/j.neuint.2018.11.004. PMID: 30465801. ↥
Edinoff, Akuly, Wagner, Boudreaux, Kaplan, Yusuf, Neuchat, Cornett, Boyer, Kaye, Kaye (2021): Viloxazine in the Treatment of Attention Deficit Hyperactivity Disorder. Front Psychiatry. 2021 Dec 17;12:789982. doi: 10.3389/fpsyt.2021.789982. PMID: 34975586; PMCID: PMC8718796., REVIEW ↥ ↥
Daberkow DP, Brown HD, Bunner KD, Kraniotis SA, Doellman MA, Ragozzino ME, Garris PA, Roitman MF (2013): Amphetamine paradoxically augments exocytotic dopamine release and phasic dopamine signals. J Neurosci. 2013 Jan 9;33(2):452-63. doi: 10.1523/JNEUROSCI.2136-12.2013. PMID: 23303926; PMCID: PMC3711765. ↥
Mergy MA, Gowrishankar R, Davis GL, Jessen TN, Wright J, Stanwood GD, Hahn MK, Blakely RD (2014): Genetic targeting of the amphetamine and methylphenidate-sensitive dopamine transporter: on the path to an animal model of attention-deficit hyperactivity disorder. Neurochem Int. 2014 Jul;73:56-70. doi: 10.1016/j.neuint.2013.11.009. PMID: 24332984; PMCID: PMC4177817. ↥
Saunders C, Ferrer JV, Shi L, Chen J, Merrill G, Lamb ME, Leeb-Lundberg LM, Carvelli L, Javitch JA, Galli A (2000): Amphetamine-induced loss of human dopamine transporter activity: an internalization-dependent and cocaine-sensitive mechanism. Proc Natl Acad Sci U S A. 2000 Jun 6;97(12):6850-5. doi: 10.1073/pnas.110035297. PMID: 10823899; PMCID: PMC18764. ↥
Mulvihill (2019): Presynaptic regulation of dopamine release: Role of the DAT and VMAT2 transporters. Neurochem Int. 2019 Jan;122:94-105. doi: 10.1016/j.neuint.2018.11.004. PMID: 30465801. REVIEW ↥
Quansah, Ruiz-Rodado, Grootveld, Zetterström (2018): Methylphenidate alters monoaminergic and metabolic pathways in the cerebellum of adolescent rats. Eur Neuropsychopharmacol. 2018 Feb 22. pii: S0924-977X(18)30043-9. doi: 10.1016/j.euroneuro.2018.02.002. ↥
Quansah, Zetterström (2019): Chronic methylphenidate preferentially alters catecholamine protein targets in the parietal cortex and ventral striatum. Neurochem Int. 2019 Jan 17;124:193-199. doi: 10.1016/j.neuint.2019.01.016. ↥
Felmer AC, Janson MT, Summers KE, Wallace LJ (2019):. Extracellular dopamine kinetic parameters consistent with amphetamine effects. Synapse. 2019 Dec;73(12):e22129. doi: 10.1002/syn.22129. PMID: 31449701. ↥
Jones SR, Gainetdinov RR, Wightman RM, Caron MG (1998): Mechanisms of amphetamine action revealed in mice lacking the dopamine transporter. J Neurosci. 1998 Mar 15;18(6):1979-86. doi: 10.1523/JNEUROSCI.18-06-01979.1998. PMID: 9482784; PMCID: PMC6792915. ↥
Müller, Candrian, Kropotov (2011), ADHS – Neurodiagnostik in der Praxis, Springer, Seiten 21, 86 ↥ ↥
Ruskin DN, Bergstrom DA, Shenker A, Freeman LE, Baek D, Walters JR (2001): Drugs used in the treatment of attention-deficit/hyperactivity disorder affect postsynaptic firing rate and oscillation without preferential dopamine autoreceptor action. Biol Psychiatry. 2001 Feb 15;49(4):340-50. doi: 10.1016/s0006-3223(00)00987-2. PMID: 11239905. ↥ ↥
Seeman P, Madras BK (1998): Anti-hyperactivity medication: methylphenidate and amphetamine. Mol Psychiatry. 1998 Sep;3(5):386-96. doi: 10.1038/sj.mp.4000421. PMID: 9774771. REVIEW ↥ ↥ ↥ ↥
Janenaite, Vengeliene, Bespalov, Behl (2017): Potential role of tyrosine hydroxylase in the loss of psychostimulant effect of amphetamine under conditions of impaired dopamine transporter activity. Behav Brain Res. 2017 Sep 15;334:105-108. doi: 10.1016/j.bbr.2017.07.028. PMID: 28750831. ↥
Rebec GV, Zimmerman KS (1980): Opposite effects of D-amphetamine on spontaneous neuronal activity in the neostriatum and nucleus accumbens. Brain Res. 1980 Nov 17;201(2):485-91. doi: 10.1016/0006-8993(80)91058-6. PMID: 7191347. ↥ ↥ ↥ ↥
Hansen EL, McKenzie GM (1979): Dexamphetamine increases striatal neuronal firing in freely moving rats. Neuropharmacology. 1979 Jun;18(6):547-52. doi: 10.1016/0028-3908(79)90099-6. PMID: 573376. ↥
Shi WX, Pun CL, Zhang XX, Jones MD, Bunney BS (2000): Dual effects of D-amphetamine on dopamine neurons mediated by dopamine and nondopamine receptors. J Neurosci. 2000 May 1;20(9):3504-11. doi: 10.1523/JNEUROSCI.20-09-03504.2000. PMID: 10777813; PMCID: PMC6773133. ↥ ↥
Newcorn JH, Ivanov I, Krone B, Li X, Duhoux S, White S, Schulz KP, Bédard AV, Pedraza J, Adler L, Blair RJ (2023): Neurobiological basis of reinforcement-based decision making in adults with ADHD treated with lisdexamfetamine dimesylate: Preliminary findings and implications for mechanisms influencing clinical improvement. J Psychiatr Res. 2023 Dec 3;170:19-26. doi: 10.1016/j.jpsychires.2023.11.037. PMID: 38101205. ↥
Marinelli M, McCutcheon JE (2014): Heterogeneity of dopamine neuron activity across traits and states. Neuroscience. 2014 Dec 12;282:176-97. doi: 10.1016/j.neuroscience.2014.07.034. PMID: 25084048; PMCID: PMC4312268. REVIEW ↥
Paladini CA, Fiorillo CD, Morikawa H, Williams JT (2001): Amphetamine selectively blocks inhibitory glutamate transmission in dopamine neurons. Nat Neurosci. 2001 Mar;4(3):275-81. doi: 10.1038/85124. PMID: 11224544. ↥
Howlett DR, Nahorski SR (1979): Acute and chronic amphetamine treatments modulate striatal dopamine receptor binding sites. Brain Res. 1979 Jan 26;161(1):173-8. doi: 10.1016/0006-8993(79)90206-3. PMID: 758968. ↥ ↥
Mang (2018): 05. Monoamine 2: Amphetamin, Ritalin (ADHS), Cocain, Tricyclika, Videovorlesung. ca. bei Minute 14:50. ↥ ↥
Kuczenski R, Segal DS (1997): Effects of methylphenidate on extracellular dopamine, serotonin, and norepinephrine: comparison with amphetamine. J Neurochem. 1997 May;68(5):2032-7. doi: 10.1046/j.1471-4159.1997.68052032.x. Erratum in: J Neurochem 1997 Sep;69(3):1332. PMID: 9109529. ↥ ↥
Lahey (Hrsg.) (2012): Advances in Clinical Child Psychology, Band 9, S. 187, mit Verweis auf [Brown, Ebert, Hunt, Rapoport (1981): Urinary 3-methoxy-4-hydroxyphenylglycol and homovanillic acid response to d-amphetamine in hyperactive children; Biological Psychiatry, Vol 16(8), Aug 1981, 779-787 ↥
Shekim, Dekirmenjian, Chapel, (1979): Urinary MHPG excretion in minimal brain dysfunction and its modification by d-amphetamine; The American Journal of Psychiatry, Vol 136(5), May 1979, 667-671. http://dx.doi.org/10.1176/ajp.136.5.667 ↥
Shen, Wang (1984): Urinary 3-methoxy-4-hydroxyphenylglycol sulfate excretion in seventy-three schoolchildren with minimal brain dysfunction syndrome.Biological Psychiatry [1984, 19(6):861-870]; PMID:6743722 ↥
Lahey (Hrsg.) (2012): Advances in Clinical Child Psychology, Band 9, S. 187, mit Verweis u.a. auf Shekim, Dekirmenjian, Chapel, (1979): Urinary MHPG excretion in minimal brain dysfunction and its modification by d-amphetamine; The American Journal of Psychiatry, Vol 136(5), May 1979, 667-671. http://dx.doi.org/10.1176/ajp.136.5.667 ↥
Paladini CA, Williams JT (2004): Noradrenergic inhibition of midbrain dopamine neurons. J Neurosci. 2004 May 12;24(19):4568-75. doi: 10.1523/JNEUROSCI.5735-03.2004. PMID: 15140928; PMCID: PMC6729397. ↥
Shi WX, Zhang XY, Pun CL, Bunney BS (2007): Clozapine blocks D-amphetamine-induced excitation of dopamine neurons in the ventral tegmental area. Neuropsychopharmacology. 2007 Sep;32(9):1922-8. doi: 10.1038/sj.npp.1301334. PMID: 17299514. ↥
Shen, Shi (2020): Amphetamine promotes cortical Up state: Role of adrenergic receptors. Addict Biol. 2020 Jan 31;e12879. doi: 10.1111/adb.12879. PMID: 32003119. ↥
Shen, Shi (2021): Amphetamine Promotes Cortical Up State in Part Via Dopamine Receptors. Front Pharmacol. 2021 Aug 19;12:728729. doi: 10.3389/fphar.2021.728729. PMID: 34489713; PMCID: PMC8417369. ↥ ↥
Mang (2018): 05. Monoamine 2: Amphetamin, Ritalin (ADHS), Cocain, Tricyclika, Videovorlesung. ca. bei Minute 14:30. ↥ ↥ ↥
Castellanos FX, Acosta MT (2011): Hacia un entendimiento de los mecanismos moleculares de los tratamientos farmacologicos del trastorno por deficit de atencion/hiperactividad [Towards an understanding of the molecular mechanisms underlying the pharmacological treatments of attention deficit hyperactivity disorder]. Rev Neurol. 2011 Mar 1;52 Suppl 1:S155-60. Spanish. PMID: 21365598. REVIEW ↥
Heinz (2000, 2013): Das dopaminerge Verstärkungssystem – Funktion, Interaktion mit anderen Neurotransmittersystemen und psychopathologische Korrelate, Seite 61 ↥
Callaway, Johnson, Gold, Nichols, Geyer (1991): Amphetamine derivatives induce locomotor hyperactivity by acting as indirect serotonin agonists; Psychopharmacology (Berl). 1991;104(3):293-301 ↥ ↥
Tsuchida, Kubo, Shintani, Abe, Köves, Uetsuki, Kuroda, Hashimoto, Baba (2009): Inhibitory effects of osemozotan, a serotonin 1A-receptor agonist, on methamphetamine-induced c-Fos expression in prefrontal cortical neurons. Biol Pharm Bull. 2009 Apr;32(4):728-31. doi: 10.1248/bpb.32.728. PMID: 19336914. ↥
Strajhar, Vizeli, Patt, Dolder, Kratschmar, Liechti, Odermatt (2018): Effects of lisdexamfetamine on plasma steroid concentrations compared with d-amphetamine in healthy subjects: A randomized, double-blind, placebo-controlled study. J Steroid Biochem Mol Biol. 2019 Feb;186:212-225. doi: 10.1016/j.jsbmb.2018.10.016. PMID: 30381248. ↥ ↥ ↥
Soto, Wilcox, Zhou, Kumar, Ator, Riddle, Wong, Weed (2013): Long-term exposure to oral methylphenidate or dl-amphetamine mixture in peri-adolescent rhesus monkeys: effects on physiology, behavior, and dopamine system development. Neuropsychopharmacology. 2012 Nov;37(12):2566-79. doi: 10.1038/npp.2012.119. Erratum in: Neuropsychopharmacology. 2013 May;38(6):1141. Kumar, Anil [added]. PMID: 22805599; PMCID: PMC3473325. ↥
Mattison, Plant, Lin, Chen, Chen, Twaddle, Doerge, Slikker, Patton, Hotchkiss, Callicott, Schrader, Turner, Kesner, Vitiello, Petibone, Morris (2011): Pubertal delay in male nonhuman primates (Macaca mulatta) treated with methylphenidate. Proc Natl Acad Sci U S A. 2011 Sep 27;108(39):16301-6. doi: 10.1073/pnas.1102187108. PMID: 21930929; PMCID: PMC3182701. ↥
Tsai, Chiao, Lu, Doong, Chen, Shih, Liaw, Wang, Wang (1996): Inhibition by amphetamine of testosterone secretion through a mechanism involving an increase of cyclic AMP production in rat testes. Br J Pharmacol. 1996 Jun;118(4):984-8. doi: 10.1111/j.1476-5381.1996.tb15496.x. PMID: 8799572; PMCID: PMC1909523. ↥ ↥
Tsai, Chen, Chiao, Lu, Lin, Yeh, Lo, Kau, Wang, Wang (1997): The role of cyclic AMP production, calcium channel activation and enzyme activities in the inhibition of testosterone secretion by amphetamine. Br J Pharmacol. 1997 Nov;122(5):949-55. doi: 10.1038/sj.bjp.0701463. PMID: 9384514; PMCID: PMC1565017. ↥
Angenoorth TJF, Stankovic S, Niello M, Holy M, Brandt SD, Sitte HH, Maier J (2021): Interaction Profiles of Central Nervous System Active Drugs at Human Organic Cation Transporters 1-3 and Human Plasma Membrane Monoamine Transporter. Int J Mol Sci. 2021 Nov 30;22(23):12995. doi: 10.3390/ijms222312995. PMID: 34884800; PMCID: PMC8657792. ↥ ↥
Amphoux A, Vialou V, Drescher E, Brüss M, Mannoury La Cour C, Rochat C, Millan MJ, Giros B, Bönisch H, Gautron S (2006): Differential pharmacological in vitro properties of organic cation transporters and regional distribution in rat brain. Neuropharmacology. 2006 Jun;50(8):941-52. doi: 10.1016/j.neuropharm.2006.01.005. PMID: 16581093. ↥ ↥ ↥
Orrico-Sanchez A, Chausset-Boissarie L, Alves de Sousa R, Coutens B, Rezai Amin S, Vialou V, Louis F, Hessani A, Dansette PM, Zornoza T, Gruszczynski C, Giros B, Guiard BP, Acher F, Pietrancosta N, Gautron S (2020): Antidepressant efficacy of a selective organic cation transporter blocker in a mouse model of depression. Mol Psychiatry. 2020 Jun;25(6):1245-1259. doi: 10.1038/s41380-019-0548-4. PMID: 31619760. ↥
Bacq A, Balasse L, Biala G, Guiard B, Gardier AM, Schinkel A, Louis F, Vialou V, Martres MP, Chevarin C, Hamon M, Giros B, Gautron S (2012): Organic cation transporter 2 controls brain norepinephrine and serotonin clearance and antidepressant response. Mol Psychiatry. 2012 Sep;17(9):926-39. doi: 10.1038/mp.2011.87. PMID: 21769100. ↥
Matochik, Liebenauer, King, Szymanski, Cohen, Zametkin (1994): Cerebral glucose metabolism in adults with attention defi cit hyperactivity disorder after chronic stimulant treatment. Am J Psychiatry 151: 658–664; Achtung, geringes N von 37; geringe Stichprobe mit n = 18; zitiert nach Edel, Vollmoeller (2006): Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung bei Erwachsenen, Springer, Seite 10 ↥
Stroemer, Kent, Hulsebosch (1998): Enhanced neocortical neural sprouting, synaptogenesis, and behavioral recovery with D-amphetamine therapy after neocortical infarction in rats; Stroke. 1998 Nov;29(11):2381-93; discussion 2393-5. ↥
Takahashi, Ohmiya, Honda, Ni (2018): The KCNH3 inhibitor ASP2905 shows potential in the treatment of attention deficit/hyperactivity disorder. PLoS One. 2018 Nov 21;13(11):e0207750. doi: 10.1371/journal.pone.0207750. eCollection 2018. ↥
Hutson, Heins, Folgering (2015): Effects of lisdexamfetamine alone and in combination with s-citalopram on acetylcholine and histamine efflux in the rat pre-frontal cortex and ventral hippocampus. J Neurochem. 2015 Aug;134(4):693-703. doi: 10.1111/jnc.13157. ↥
Madras, Miller, Fischman (2005): The dopamine transporter and attention-deficit/hyperactivity disorder. Biol Psychiatry. 2005 Jun 1;57(11):1397-409. doi: 10.1016/j.biopsych.2004.10.011. PMID: 15950014. ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥
Nagy, Häge, Coghill, Caballero, Adey, Anderson, Sikirica, Cardo (2015): Functional outcomes from a head-to-head, randomized, double-blind trial of lisdexamfetamine dimesylate and atomoxetine in children and adolescents with attention-deficit/hyperactivity disorder and an inadequate response to methylphenidate.Eur Child Adolesc Psychiatry. 2016 Feb;25(2):141-9. doi: 10.1007/s00787-015-0718-0. ↥
Madhoo, Keefe, Roth, Sambunaris, Wu, Trivedi, Anderson, Lasser (2014): Lisdexamfetamine dimesylate augmentation in adults with persistent executive dysfunction after partial or full remission of major depressive disorder; Neuropsychopharmacology. 2014 May;39(6):1388-98. doi: 10.1038/npp.2013.334. n=143 Erwachsene ↥
Coghill, Banaschewski, Nagy, Otero, Soutullo, Yan, Caballero, Zuddas (2017): Long-Term Safety and Efficacy of Lisdexamfetamine Dimesylate in Children and Adolescents with ADHD: A Phase IV, 2-Year, Open-Label Study in Europe.CNS Drugs. 2017 Jun 30. doi: 10.1007/s40263-017-0443-y; n = 314 ↥ ↥
Arnold: Journal of Attention Disorders Vol. 3(4):200-211 (2000) Methylphenidate vs. amphetamine: Comparative review n =174 ↥
Müller, Candrian, Kropotov (2011), ADHS – Neurodiagnostik in der Praxis, Seite 21 ↥
Diamond: Attention-deficit disorder (attention-deficit/hyperactivity disorder without hyperactivity): A neurobiologically and behaviorally distinct disorder from attention-deficit (with hyperactivity), Development and Psychopathology 17 (2005), 807–825, Seite 811 ↥
Liddle, Hollis, Batty, Groom, Totman, Liotti, Scerif, Liddle (2011): Task-related default mode network modulation and inhibitory control in ADHD: effects of motivation and methylphenidate. J Child Psychol Psychiatry. 2011 Jul;52(7):761-71. doi: 10.1111/j.1469-7610.2010.02333.x. ↥
ADHS-Chaoten;Thread: Amphetamin und Methylphenidat für Depressionen ↥
Adler, Goodman, Weisler, Hamdani, Roth (2009): Effect of lisdexamfetamine dimesylate on sleep in adults with attention-deficit/hyperactivity disorder. Behav Brain Funct. 2009 Aug 3;5:34. doi: 10.1186/1744-9081-5-34. PMID: 19650932; PMCID: PMC2732626. ↥
Giblin, Strobel (2011): Effect of lisdexamfetamine dimesylate on sleep in children with ADHD. J Atten Disord. 2011 Aug;15(6):491-8. doi: 10.1177/1087054710371195. PMID: 20574056. ↥
López FA, Leroux JR (2013): Long-acting stimulants for treatment of attention-deficit/hyperactivity disorder: a focus on extended-release formulations and the prodrug lisdexamfetamine dimesylate to address continuing clinical challenges. Atten Defic Hyperact Disord. 2013 Sep;5(3):249-65. doi: 10.1007/s12402-013-0106-x. PMID: 23564273; PMCID: PMC3751218. REVIEW ↥
Mattay, Goldberg, Fera, Hariri, Tessitore, Egan, Kolachana, Callicott, Weinberger (2003): Catechol O-methyltransferase val158-met genotype and individual variation in the brain response to amphetamine; doi: 10.1073/pnas.0931309100; PNAS May 13, 2003 vol. 100 no. 10 6186-6191 ↥
Childress, Newcorn, Cutler (2019): Gender Effects in the Efficacy of Racemic Amphetamine Sulfate in Children with Attention-Deficit/Hyperactivity Disorder. Adv Ther. 2019 Apr 10. doi: 10.1007/s12325-019-00942-5. ↥
Arnold (2000): L.E. Methylphenidate vs amphetamine: Comparative review, J. of Att. Disorders, 2000, Vol 3, 200ff, n = 174 ↥
Müller, Candrian, Kropotov (2011), ADHS – Neurodiagnostik in der Praxis, Springer, Seite 21 ↥
Castello et al. 1992, zitiert nach Arnold: Journal of Attention Disorders Vol. 3(4):200-211 (2000) Methylphenidate vs. amphetamine: Comparative review ↥ ↥
Brams, Weisler, Findling, Gasior, Hamdani, Ferreira-Cornwell, Squires: Maintenance of Efficacy of Lisdexamfetamine Dimesylate in Adults With Attention-Deficit/Hyperactivity Disorder: Randomized Withdrawal Design, J Clin Psychiatry 2012;73(7):977-983; 10.4088/JCP.11m07430 ↥
http://www.ads-hyperaktivitaet.de/FAQ/Infos/Medis/medis.html#1 ↥
Markowitz, Patrick (2017): The Clinical Pharmacokinetics of Amphetamines Utilized in the Treatment of Attention-Deficit/Hyperactivity Disorder. J Child Adolesc Psychopharmacol. 2017 Oct;27(8):678-689. doi: 10.1089/cap.2017.0071. PMID: 28910145. REVIEW ↥
Dolder, Strajhar, Vizeli, Hammann, Odermatt, Liechti (2017): Pharmacokinetics and Pharmacodynamics of Lisdexamfetamine Compared with D-Amphetamine in Healthy Subjects. Front Pharmacol. 2017 Sep 7;8:617. doi: 10.3389/fphar.2017.00617. PMID: 28936175; PMCID: PMC5594082. n = 24) Die Studie benennt allerdings nicht das Gewicht der Probanden, sodass keine Aussage über die Dosierung / kg Körpergewicht möglich ist. Das Gewicht ist jedoch bei der Amphetamindosierung ein relevanter Faktor.((Markowitz, Patrick (2017): The Clinical Pharmacokinetics of Amphetamines Utilized in the Treatment of Attention-Deficit/Hyperactivity Disorder. J Child Adolesc Psychopharmacol. 2017 Oct;27(8):678-689. doi: 10.1089/cap.2017.0071. PMID: 28910145. REVIEW ↥
Amphetamines. LiverTox: Clinical and Research Information on Drug-Induced Liver Injury [Internet]. Bethesda (MD): National Institute of Diabetes and Digestive and Kidney Diseases; 2012-2016 ↥
Ito, Onodera, Yamatodani, Watanabe, Sato (1997): The effect of methamphetamine on histamine release in the rat hypothalamus. Psychiatry Clin Neurosci. 1997 Apr;51(2):79-81. doi: 10.1111/j.1440-1819.1997.tb02911.x. PMID: 9141145. ↥
Ito, Onodera, Sakurai, Sato, Watanabe (1996): The effect of methamphetamine on histamine level and histidine decarboxylase activity in the rat brain. Brain Res. 1996 Sep 23;734(1-2):98-102. PMID: 8896814. ↥
Houghton, de Vries, Loss (2019): Psychostimulants/Atomoxetine and Serious Cardiovascular Events in Children with ADHD or Autism Spectrum Disorder. CNS Drugs. 2019 Nov 25. doi: 10.1007/s40263-019-00686-4. n = 2.566.995 ↥
Forns, Dudukina, Hägg, Szentkúti, Gembert, Plana, Gilsenan, Horváth-Puhó, Ehrenstein, Reutfors, Rebordosa )2022): Risk of Major Cardiovascular and Cerebrovascular Events in Users of Lisdexamfetamine and Other Medications for Attention-Deficit/Hyperactivity Disorder in Denmark and Sweden: A Population-Based Cohort Study. Neurol Ther. 2022 Aug 26. doi: 10.1007/s40120-022-00396-y. PMID: 36028603. n = 273.000 ↥
Harris E. Long-Term ADHD Medications and Cardiovascular Disease Risk. JAMA. 2023 Dec 26;330(24):2331. doi: 10.1001/jama.2023.24173. PMID: 38055293. n = 60.000 ↥
Chan M, Chan JJ, Wright JM (2025): Effect of amphetamines on blood pressure. Cochrane Database Syst Rev. 2025 Mar 28;3(3):CD007896. doi: 10.1002/14651858.CD007896.pub4. PMID: 40152309; PMCID: PMC11951410. REVIEW ↥
Manso, Morcillo, Pereira, Maldonado (2020): Tricotilomanía de nueva aparición durante el tratamiento con fármacos estimulantes. A propósito de dos casos clínicos pediátricos [New-onset trichotillomania during treatment with stimulant drugs. About two pediatric clinical cases]. Arch Argent Pediatr. 2020 Feb;118(1):e61-e62. Spanish. doi: 10.5546/aap.2020.e61. PMID: 31984712. ↥
Abdalla TE, Kotsonis D, Best J, Ramasamy R, Wood E (2021): Stimulant-Induced Pituitary Failure and Reversible Azoospermia. Cureus. 2021 Apr 3;13(4):e14269. doi: 10.7759/cureus.14269. PMID: 33959450; PMCID: PMC8093113. ↥
Assem-Hilger, Kasper (2005): Psychopharmaka und sexuelle Dysfunktion. Journa lfür Neurologie, Neurochirurgie und Psychiatrie; 2005, 30-36 ↥
Duca Y, Aversa A, Condorelli RA, Calogero AE, La Vignera S (2019): Substance Abuse and Male Hypogonadism. J Clin Med. 2019 May 22;8(5):732. doi: 10.3390/jcm8050732. PMID: 31121993; PMCID: PMC6571549. REVIEW ↥ ↥
Strajhar P, Vizeli P, Patt M, Dolder PC, Kratschmar DV, Liechti ME, Odermatt A (2019): Effects of lisdexamfetamine on plasma steroid concentrations compared with d-amphetamine in healthy subjects: A randomized, double-blind, placebo-controlled study. J Steroid Biochem Mol Biol. 2019 Feb;186:212-225. doi: 10.1016/j.jsbmb.2018.10.016. PMID: 30381248. n = 24 ↥
Yamamoto Y, Yamamoto K, Hayase T (1999): Effect of methamphetamine on male mice fertility. J Obstet Gynaecol Res. 1999 Oct;25(5):353-8. doi: 10.1111/j.1447-0756.1999.tb01176.x. PMID: 10533332. ↥
Lin JF, Lin YH, Liao PC, Lin YC, Tsai TF, Chou KY, Chen HE, Tsai SC, Hwang TI (2014): Induction of testicular damage by daily methamphetamine administration in rats. Chin J Physiol. 2014 Feb 28;57(1):19-30. doi: 10.4077/CJP.2014.BAB155. PMID: 24621335. ↥
Kaewman P, Nudmamud-Thanoi S, Thanoi S (2018): GABAergic Alterations in the Rat Testis after Methamphetamine Exposure. Int J Med Sci. 2018 Aug 10;15(12):1349-1354. doi: 10.7150/ijms.27609. PMID: 30275762; PMCID: PMC6158670. ↥
Dickerson SM, Walker DM, Reveron ME, Duvauchelle CL, Gore AC (2008): The recreational drug ecstasy disrupts the hypothalamic-pituitary-gonadal reproductive axis in adult male rats. Neuroendocrinology. 2008;88(2):95-102. doi: 10.1159/000119691. PMID: 18309234; PMCID: PMC2753463. ↥
Barenys M, Macia N, Camps L, de Lapuente J, Gomez-Catalan J, Gonzalez-Linares J, Borras M, Rodamilans M, Llobet JM (2009): Chronic exposure to MDMA (ecstasy) increases DNA damage in sperm and alters testes histopathology in male rats. Toxicol Lett. 2009 Dec 1;191(1):40-6. doi: 10.1016/j.toxlet.2009.08.002. PMID: 19683041. ↥ ↥
Yamamoto Y, Yamamoto K, Hayase T, Abiru H, Shiota K, Mori C (2002): Methamphetamine induces apoptosis in seminiferous tubules in male mice testis. Toxicol Appl Pharmacol. 2002 Feb 1;178(3):155-60. doi: 10.1006/taap.2001.9330. PMID: 11858731. ↥
Alavi SH, Taghavi MM, Moallem SA (2008): Evaluation of effects of methamphetamine repeated dosing on proliferation and apoptosis of rat germ cells. Syst Biol Reprod Med. 2008 Mar-Apr;54(2):85-91. doi: 10.1080/19396360801952078. PMID: 18446649. ↥
Nudmamud-Thanoi S, Thanoi S (2011): Methamphetamine induces abnormal sperm morphology, low sperm concentration and apoptosis in the testis of male rats. Andrologia. 2011 Aug;43(4):278-82. doi: 10.1111/j.1439-0272.2010.01071.x. PMID: 21486410. ↥
Saberi A, Sepehri G, Safi Z, Razavi B, Jahandari F, Divsalar K, Salarkia E (2017): Effects of Methamphetamine on Testes Histopathology and Spermatogenesis Indices of Adult Male Rats. Addict Health. 2017 Fall;9(4):199-205. PMID: 30574282; PMCID: PMC6294480. ↥
Mobaraki F, Seghatoleslam M, Fazel A, Ebrahimzadeh-Bideskan A (2018): Effects of MDMA (ecstasy) on apoptosis and heat shock protein (HSP70) expression in adult rat testis. Toxicol Mech Methods. 2018 Mar;28(3):219-229. doi: 10.1080/15376516.2017.1388461. PMID: 29105552. ↥
Levine LA, Betcher HK, Ziegelmann MJ, Bajic P (2020): Amphetamine/Dextroamphetamine Salts for Delayed Orgasm and Anorgasmia in Men: A Pilot Study. Urology. 2020 Aug;142:141-145. doi: 10.1016/j.urology.2020.04.081. PMID: 32360625. n = 17 ↥
Bartlik BD, Kaplan P, Kaplan HS (1995): Psychostimulants apparently reverse sexual dysfunction secondary to selective serotonin re-uptake inhibitors. J Sex Marital Ther. 1995 Winter;21(4):264-71. doi: 10.1080/00926239508414646. PMID: 8789508. ↥
Coskun M, Zoroglu S (2009): A report of two cases of sexual side effects with OROS methylphenidate. J Child Adolesc Psychopharmacol. 2009 Aug;19(4):477-9. doi: 10.1089/cap.2008.0161. PMID: 19702503. ↥
Cakin-Memik N, Yildiz O, Sişmanlar SG, Karakaya I, Ağaoğlu B (2010): Priapism associated with methylphenidate: a case report. Turk J Pediatr. 2010 Jul-Aug;52(4):430-4. PMID: 21043394. ↥
Ostdiek-Wille GP, Bavitz KC, Kohn TP, Deibert CM (2023): Attention-deficit hyperactivity disorder medication use is associated with testosterone hypofunction-results from a national claims database analysis. Int J Impot Res. 2023 Dec 21. doi: 10.1038/s41443-023-00805-2. PMID: 38129694. n = 34.448 ↥
Ermer J, Haffey MB, Richards C, Lasseter K, Adeyi B, Corcoran M, Stanton B, Martin P (2013): Double-blind, placebo-controlled, two-period, crossover trial to examine the pharmacokinetics of lisdexamfetamine dimesylate in healthy older adults. Neuropsychiatr Dis Treat. 2013;9:219-29. doi: 10.2147/NDT.S38377. PMID: 23431065; PMCID: PMC3575217. ↥
Mang (2018): 05. Monoamine 2: Amphetamin, Ritalin (ADHS), Cocain, Tricyclika, Videovorlesung. ca. bei Minute 38. ↥
Spiller HA, Hays HL, Aleguas A Jr (2013): Overdose of drugs for attention-deficit hyperactivity disorder: clinical presentation, mechanisms of toxicity, and management. CNS Drugs. 2013 Jul;27(7):531-43. doi: 10.1007/s40263-013-0084-8. PMID: 23757186. REVIEW ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥
Fitzgerald KT, Bronstein AC (2013): Adderall® (amphetamine-dextroamphetamine) toxicity. Top Companion Anim Med. 2013 Feb;28(1):2-7. doi: 10.1053/j.tcam.2013.03.002. PMID: 23796480. ↥ ↥ ↥ ↥ ↥ ↥ ↥
Honório da Silva JV, Erthal RP, Vercellone IC, Santos DPD, Ferraz CR, de Matos RLN, Gonçalves LED, Bracarense APFRL, Verri WA Jr, Câmara NOS, de Andrade FG, Fernandes GSA (2024): Lisdexamfetamine dimesylate-exposition in male rats during the peripubertal period impairs inflammatory mechanisms, antioxidant activity, and apoptosis process in kidneys of male pubertal rats. J Biochem Mol Toxicol. 2024 Aug;38(8):e23781. doi: 10.1002/jbt.23781. PMID: 39051179. ↥
Sharman J, Pennick M (2014): Lisdexamfetamine prodrug activation by peptidase-mediated hydrolysis in the cytosol of red blood cells. Neuropsychiatr Dis Treat. 2014 Nov 28;10:2275-80. doi: 10.2147/NDT.S70382. PMID: 25489246; PMCID: PMC4257105. ↥
Ward K, Citrome L (2018): Lisdexamfetamine: chemistry, pharmacodynamics, pharmacokinetics, and clinical efficacy, safety, and tolerability in the treatment of binge eating disorder. Expert Opin Drug Metab Toxicol. 2018 Feb;14(2):229-238. doi: 10.1080/17425255.2018.1420163. PMID: 29258368. REVIEW ↥ ↥
Konstantinidis: CYP-450-Interaktionen: Die Isoenzyme CYP1A2 und CYP2D6; Österreichische Gesellschaft für Neuropsychopharmakologie und Biologische Psychiatrie; Webseitenabruf 23.12.19 ↥
Law R, Lewis D, Hain D, Daut R, DelBello MP, Frazier JA, Newcorn JH, Nurmi E, Cogan ES, Wagner S, Johnson H, Lanchbury J (2022): Characterisation of seven medications approved for attention-deficit/hyperactivity disorder using in vitro models of hepatic metabolism. Xenobiotica. 2022 Nov 1:1-32. doi: 10.1080/00498254.2022.2141151. PMID: 36317558. ↥
Bach MV, Coutts RT, Baker GB (1999): Involvement of CYP2D6 in the in vitro metabolism of amphetamine, two N-alkylamphetamines and their 4-methoxylated derivatives. Xenobiotica. 1999 Jul;29(7):719-32. doi: 10.1080/004982599238344. PMID: 10456690. ↥
Wu D, Otton SV, Inaba T, Kalow W, Sellers EM (1997): Interactions of amphetamine analogs with human liver CYP2D6. Biochem Pharmacol. 1997 Jun 1;53(11):1605-12. doi: 10.1016/s0006-2952(97)00014-2. PMID: 9264312. ↥ ↥
Phamarkogenetik.de: Cytochrom P450 2D6 (CYP2D6) [T88.7] Abruf 25.03.2022 ↥ ↥
Russell DJ, Wyrwoll CS, Preen DB, Kelty E (2024): Investigating maternal and neonatal health outcomes associated with continuing or ceasing dexamphetamine treatment for women with attention-deficit hyperactivity disorder during pregnancy: a retrospective cohort study. Arch Womens Ment Health. 2024 Mar 1. doi: 10.1007/s00737-024-01450-4. PMID: 38424254. ↥
Suarez EA, Bateman BT, Hernandez-Diaz S, Straub L, McDougle CJ, Wisner KL, Gray KJ, Pennell PB, Lester B, Zhu Y, Mogun H, Huybrechts KF (2024): Prescription Stimulant Use During Pregnancy and Risk of Neurodevelopmental Disorders in Children. JAMA Psychiatry. 2024 Jan 24:e235073. doi: 10.1001/jamapsychiatry.2023.5073. PMID: 38265792; PMCID: PMC10809143. n = 4,3 Mio ↥
Bang Madsen K, Larsson H, Skoglund C, Liu X, Munk-Olsen T, Bergink V, Newcorn JH, Cortese S, Lichtenstein P, Kuja-Halkola R, Chang Z, D’Onofrio B, Hove Thomsen P, Klungsøyr K, Brikell I, Garcia-Argibay M (2025): In utero exposure to methylphenidate, amphetamines and atomoxetine and offspring neurodevelopmental disorders - a population-based cohort study and meta-analysis. Mol Psychiatry. 2025 Mar 27. doi: 10.1038/s41380-025-02968-4. PMID: 40148550. ↥
Rose, Hathcock, White, Borowski, Rivera-Chiauzzi (2020): Amphetamine-Dextroamphetamine and Pregnancy: Neonatal Outcomes After Prenatal Prescription Mixed Amphetamine Exposure. J Atten Disord. 2020 Jan 13:1087054719896857. doi: 10.1177/1087054719896857. ↥
Bro, Kjaersgaard, Parner, Sørensen, Olsen, Bech, Pedersen, Christensen, Vestergaard (2015): Adverse pregnancy outcomes after exposure to methylphenidate or atomoxetine during pregnancy. Clin Epidemiol. 2015 Jan 29;7:139-47. doi: 10.2147/CLEP.S72906. eCollection 2015. ↥
Cohen, Hernández-Díaz, Bateman, Park, Desai, Gray, Patorno, Mogun, Huybrechts (2017): Placental Complications Associated With Psychostimulant Use in Pregnancy. Obstet Gynecol. 2017 Dec;130(6):1192-1201. doi: 10.1097/AOG.0000000000002362. ↥
Haervig, Mortensen, Hansen, Strandberg-Larsen (2014): Use of ADHD medication during pregnancy from 1999 to 2010: a Danish register-based study. Pharmacoepidemiol Drug Saf. 2014 May;23(5):526-33. doi: 10.1002/pds.3600. n = 480 unter 1.054.494 Geburten ↥
Pottegård, Hallas, Andersen, Løkkegaard, Dideriksen, Aagaard, Damkier (2014): First-trimester exposure to methylphenidate: a population-based cohort study. J Clin Psychiatry. 2014 Jan;75(1):e88-93. doi: 10.4088/JCP.13m08708. ↥
Szpunar MJ, Freeman MP, Kobylski LA, Rossa ET, Gaccione P, Chitayat D, Viguera AC, Cohen LS (2023): Risk of Major Malformations in Infants After First-Trimester Exposure to Stimulants: Results From the Massachusetts General Hospital National Pregnancy Registry for Psychiatric Medications. J Clin Psychopharmacol. 2023 Jul-Aug 01;43(4):326-332. doi: 10.1097/JCP.0000000000001702. PMID: 37235505. ↥
Moran, Ongur, Hsu, Castro, Perlis, Schneeweiss (2019): Psychosis with Methylphenidate or Amphetamine in Patients with ADHD. N Engl J Med. 2019 Mar 21;380(12):1128-1138. doi: 10.1056/NEJMoa1813751. n = 221.846 ↥
Jongsma, Gayer-Anderson, Lasalvia, Quattrone, Mulè, Szöke, Selten, Turner, Arango, Tarricone, Berardi, Tortelli, Llorca, de Haan, Bobes, Bernardo, Sanjuán, Santos, Arrojo, Del-Ben, Menezes, Velthorst, Murray, Rutten, Jones, van Os, Morgan, Kirkbride; for the European Network of National Schizophrenia Networks Studying Gene-Environment Interactions Work Package 2 (EU-GEI WP2) Group(2018): Treated Incidence of Psychotic Disorders in the Multinational EU-GEI Study. JAMA Psychiatry. 2018;75(1):36–46. doi:10.1001/jamapsychiatry.2017.3554; n = 12,9 Millionen Personenjahre ↥
Gelbe Liste: Dexamfetamin. Abgerufen 12.02.23 ↥ ↥ ↥
Cosgrove K, Johnston CS (2017): Examining the Impact of Adherence to a Vegan Diet on Acid-Base Balance in Healthy Adults. Plant Foods Hum Nutr. 2017 Sep;72(3):308-313. doi: 10.1007/s11130-017-0620-7. PMID: 28677099. ↥
Osuna-Padilla IA, Leal-Escobar G, Garza-García CA, Rodríguez-Castellanos FE (2019): Dietary Acid Load: mechanisms and evidence of its health repercussions. Nefrologia (Engl Ed). 2019 Jul-Aug;39(4):343-354. English, Spanish. doi: 10.1016/j.nefro.2018.10.005. PMID: 30737117. REVIEW ↥
Passey C (2017): Reducing the Dietary Acid Load: How a More Alkaline Diet Benefits Patients With Chronic Kidney Disease. J Ren Nutr. 2017 May;27(3):151-160. doi: 10.1053/j.jrn.2016.11.006. PMID: 28117137 REVIEW ↥
Terrillion CE, Dao DT, Cachope R, Lobo MK, Puche AC, Cheer JF, Gould TD (2017): Reduced levels of Cacna1c attenuate mesolimbic dopamine system function. Genes Brain Behav. 2017 Jun;16(5):495-505. doi: 10.1111/gbb.12371. PMID: 28186690; PMCID: PMC5457318. ↥
Schoretsanitis, de Leon, Eap, Kane, Paulzen (2019): Clinically Significant Drug-Drug Interactions with Agents for Attention-Deficit/Hyperactivity Disorder. CNS Drugs. 2019 Dec;33(12):1201-1222. doi: 10.1007/s40263-019-00683-7. ↥ ↥ ↥
Pharmazeutische Zeitung: Lisdexamfetamin; abgerufen 10.02.21 ↥ ↥ ↥ ↥
Benassayag Kaduri N, Hazan A, De-Haan T, Kohn E, Berkovitch M, Berlin M (2024): Amphetamine use for attention deficit hyperactive disorder during breastfeeding and children’s neurodevelopmental outcomes: A pilot study. Psychiatry Res. 2024 Jun 17;339:116047. doi: 10.1016/j.psychres.2024.116047. PMID: 38908263. ↥
Castells, Ramon, Cunill, Olivé, Serrano (2020): Relationship Between Treatment Duration and Efficacy of Pharmacological Treatment for ADHD: A Meta-Analysis and Meta-Regression of 87 Randomized Controlled Clinical Trials. J Atten Disord. 2020 Feb 20:1087054720903372. doi: 10.1177/1087054720903372. PMID: 32075485. ↥
