Das vegetative Nervensystem: Sympathikus / Parasympathikus
Das vegetative Nervensystem (VNS) besteht aus zwei Teilen, dem (eher aktivierenden) Sympathikus und dem (eher hemmenden) Parasympathikus. Diese beiden Systeme bilden ein dynamisches Gleichgewicht.
Sympathikus und Parasympathikus werden über verschiedene Gehirnregionen gesteuert. Der Sympathikus wird durch den paraventrikulären Nucleus, den Locus coeruleus und die ventrolaterale Medulla aktiviert. Der Parasympathikus wird durch den Nucleus tractus solitarius, den dorsalen motorischen Nucleus des Vagusnervs und den Nucleus ambiguus gesteuert.
Das vegetative Nervensystem ist teilautonom, d.h. viele Reaktionen werden direkt im Rückenmark ohne Beteiligung des Gehirns gesteuert, während andere durch übergeordnete Instanzen (Hypothalamus, Hirnstamm, limbisches System) geregelt werden.
Sympathikus und Parasympathikus sind nicht wie eine Wippe starr miteinander verbunden, sondern können unabhängig voneinander aktiv oder passiv sein.
Die meisten Erfüllungsorgane sind mit Sympathikus und Parasympathikus über direkte Nerven verbunden. Die Steuerung erfolgt präganglionär über Acetylcholin und postganglionär über Noradrenalin. Je nach Organ wirken beide Neurotransmitter hemmend oder anregend.
In Stresssituationen reagiert das sympathische Nervensystem, indem es Organe aktiviert und die Herzfrequenz, Atmung und den Blutdruck erhöht. Eine erhöhte Alarmbereitschaft und gesteigertes Fluchtverhalten sind die Folgen. Der Alpha-Amylase-Spiegel im Speichel gilt als Biomarker des sympathischen Nervensystems.
Die Aktivität des vegetativen Nervensystems kann durch die Messung der Herzratenvariabilität bestimmt werden.
Eine Metastudie von 55 Untersuchungen zum VNS bei ADHS fand bei knapp der Hälfte der Untersuchungen keinen Einfluss des VNS auf ADHS. Gleichwohl beeinflussen Stimulanzien und Belohnungen das VNS.1
Bei ADHS sind die Adrenalinwerte verringert und der Parasympathikus überhöht und unflexibel. Die Befunde zum Sympathikus bei ADHS sind uneinheitlich. ADHS-Medikamente können Veränderungen im vegetativen Nervensystem bewirken und die Aktivität von Sympathikus und Parasympathikus nahezu ausgleichen.
- 1. Sympathikus (aktivierend)
- 2. Parasympathikus, Vagus (hemmend)
- 3. Steuerung von Sympathikus, Parasympathikus und HPA-Achse
- 4. Stressreaktion des vegetativen Nervensystems
- 5. Alpha-Amylase als Biomarker des vegetativen Nervensystems
- 6. Messung des vegetativen Nervensystems mittels Herzratenvariabilität (HRV)
- 7. Vegetatives Nervensystem und ADHS
- 8. Veränderungen des vegetativen Nervensystems durch ADHS-Medikamente
- 9. Parasympathikus / Sympathikus bei anderen Störungsbildern
1. Sympathikus (aktivierend)
Der Sympathikus fördert die Leistungsbereitschaft, aktiviert und alarmiert.
Seine Nerven führen vom Hirnstamm zum Brust- und Lendenteil des Rückenmarks.
Der Sympathikus ist ein Netzwerk aus den Gehirnregionen2
- PVN, paraventrikulärer Nucleus / Nucleus paraventricularis
- ein Kern des Hypothalamus
- produziert
- Oxytocin
- Antidiuretisches Hormon (gering)
- CRH
- Locus coeruleus
- produziert Noradrenalin
- ventrolaterale Medulla
- produziert Noradrenalin
- reguliert
- arteriellen Blutdruck
- Atmung
Die Transmittersteuerung des Sympathikus erfolgt präganglionär (bis zum Ganglion) via Acetylcholin.
Bindung an Cholinozeptoren:
- n-Rezeptoren (nicotinerg)
Die Transmittersteuerung postganglionär (ab dem Ganglion) erfolgt via Noradrenalin.
Bindung an Adrenorezeptoren:
- alpha-Rezeptoren
- beta-Rezeptoren
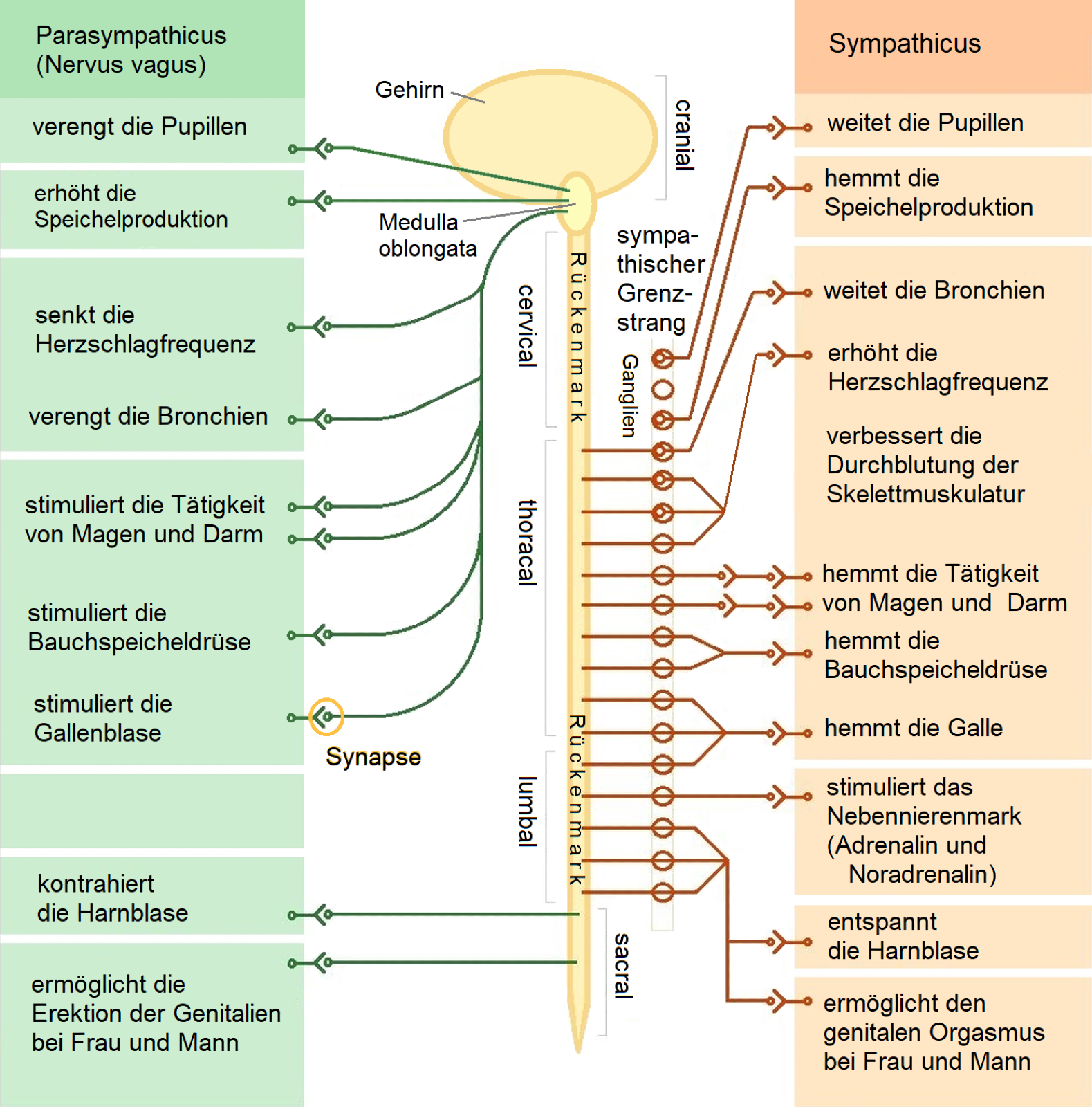
Grafik von : Sciencia58, CC BY-SA 3.0, File: Das vegetative Nervensystem.png - Wikimedia Commons
2. Parasympathikus, Vagus (hemmend)
Der Parasympathikus hemmt die Leistungsbereitschaft, beruhigt und wirkt verdauungsfördernd.
Seine Nerven führen vom Hirnstamm durch die Hirnnerven/Schädelnerven und den Kreuzbeinbereich des Rückenmarks durch die Rückenmarksnerven.
Der Parasympathikus ist ein Netzwerk aus den Gehirnregionen2
- NTS, Nucleus tractus solitarius
- steuert
- Geschmackswahrnehmung (“Geschmackskern”)
- Atemreflex
- Würgereflex
- Brechreflex
- steuert
- DMX, Nucleus dorsalis nervi vagi, dorsaler motorischer Nucleus des Vagus
- Teil der Medulla oblongata
- NA, Nucleus ambiguus
- Teil der Medulla oblongata
Die Transmittersteuerung des Parasympathikus erfolgt präganglionär (bis zum Ganglion) sowie postganglionär (ab dem Ganglion) durch Acetylcholin.
Bindung an Cholinozeptoren
- n-Rezeptoren (nicotinerg)
- m-Rezeptoren (muscarinerg)
3. Steuerung von Sympathikus, Parasympathikus und HPA-Achse
Hypothalamus und Hirnstamm moderieren die Aktionen des Sympathikus und Parasympathikus, um die sich ständig ändernden Verhältnisse des Körpers im so genannten homöostatischen Gleichgewicht zu halten.
Während die HPA-Achse mittels Neurotransmittern und Hormonen (endokrin) angesteuert wird, wird das vegetative Nervensystem neuronal (elektrisch) angesteuert. Daher erfolgt die Reaktion des vegetativen Nervensystems wesentlich schneller.
3.1. Aktivierung des Sympathikus
- Amygdala →
und - intralimbischer Kortex →
- → Nucleus des solitären Trakts →
- → Locus coeruleus →
- → Sympathikus
- → ventrolaterale Medulla →
- → Sympathikus
- → Hypothalamus (dort: paraventrikulärer Nucleus) →
- → Sympathikus
- → Locus coeruleus →
- → Nucleus des solitären Trakts →
- dorsomedialer Hypothalamus →
- → Hypothalamus (dort: paraventrikulärer Nucleus) →
- → Sympathikus
- → Hypothalamus (dort: paraventrikulärer Nucleus) →
Quelle3
3.2. Aktivierung des Parasympathikus
- Stria terminalis (dort: vorderer Bettkern) →
- → Hypothalamus (dort: paraventrikulärer Nucleus) →
- → dorsaler motorischer Nucleus des Vagusnervs →
- → Parasympathikus
- → dorsaler motorischer Nucleus des Vagusnervs →
- → Nucleus des solitären Trakts →
- → dorsaler motorischer Nucleus des Vagusnervs →
- → Parasympathikus
- → Nucleus ambiguus →
- → Parasympathikus
- → dorsaler motorischer Nucleus des Vagusnervs →
- → Hypothalamus (dort: paraventrikulärer Nucleus) →
- prälimbischer Kortex →
- → Nucleus ambiguus →
- → Parasympathikus
- → Nucleus ambiguus →
Quelle3
4. Stressreaktion des vegetativen Nervensystems
4.1. Auslöser
- große Anstrengung
- emotionaler Stress
- starke Schmerzen
- großer Flüssigkeitsmangel
4.2. Reaktion
Noradrenalin aktiviert über das sympathische Nervensystem weitere Organe des Körpers.
Adrenalin wird durch das Nebennierenmark freigesetzt.
- erhöhte Herzfrequenz
(Noradrenalin und Adrenalin via β1-Rezeptoren) - beschleunigte Atmung
(Noradrenalin und Adrenalin via β2-Rezeptoren) - Erhöhung des Blutdrucks
(Noradrenalin und Adrenalin via alpha1- und β-Rezeptoren) - Pupillenerweiterung
- erhöhte Versorgung der Skelettmuskulatur mit sauerstoffreichem Blut zur Vorbereitung der Fight or Flight-Reaktion
- Noradrenalin und Adrenalin drosseln über β3-Rezeptoren die Blutversorgung für im Moment unwichtige Organe
- Darm
- Haut (Verblutungsgefahr bei Verletzung / Kampf verringern, Körperwärme steigern)
- Stimulation der Leber, um energiereiche Glucose freizusetzen
- Schweißdrüsen aktiviert (kalter Schweiß)
- Stimulation der Nebenniere
Verstärkung der Alarmbereitschaft durch- erhöhte Freisetzung von Adrenalin
- erhöhte Freisetzung von Noradrenalin
4.3. Wirkung
- erhöhte Alarmbereitschaft
- erhöhtes Fluchtverhalten
- erhöhter Energieverbrauch
Eine ähnliche Wirkung scheint im zentralen Nervensystem (Gehirn und Rückenmark) zu bestehen, wo der PFC das “verdauungsfördernde” Organ ist, das durch mäßige Noradrenalinspiegel gestärkt und durch hohe Noradrenalinspiegel abgeschaltet wird, während die sensomotorischen und affektiven Regionen des Gehirns durch höhere Mengen an Noradrenalin verstärkt werden.4
5. Alpha-Amylase als Biomarker des vegetativen Nervensystems
So wie Cortisol als letztes Hormon der HPA-Achse ein (z.B. im Speichel) ein sehr gut messbarer Biomarker der HPA-Achse ist, bildet der Alpha-Amylase-Spiegel die Reaktivität des sympathischen Nervensystems ab.56
Beide Biomarker können einfach im Speichel gemessen werden.
Mehr zu Alpha-Amylase bei ADHS und dessen Zusammenspiel mit Cortisol findet sich unter ⇒ α-Amylase bei ADHS sowie ⇒ Korrelation zwischen Alpha-Amylase und Cortisol.
6. Messung des vegetativen Nervensystems mittels Herzratenvariabilität (HRV)
Die Aktivität des vegetativen Nervensystems, insbesondere die des Parasympathikus, kann noninvasiv durch Messung der Herzratenvariabilität erfolgen. Hieraus ergeben sich interessante Ansätze zur Diagnostik und Therapie.
⇒ Herzratenvariabilität (HRV) bei ADHS
7. Vegetatives Nervensystem und ADHS
Eine Metastudie zum vegetativen Nervensystem bei ADHS fand:7
- 2 Studien berichteten einen verminderten Sympathikustonus
- 7 Studien berichteten eine geringere sympathische Reaktivität bei Aufgabenanforderungen / auf Stress
- 1 Studie berichtete einen verminderten Vagustonus
Es fanden sich keine Hinweise auf eine veränderte aufgabenbezogene parasympathische Reaktivität.
7.1. Adrenalinwerte bei ADHS verringert
Adrenalin wird üblicherweise im Urin gemessen.
Zu den grundlegenden Funktionen von Adrenalin: ⇒ Neurotransmitter – Botenstoffe.
- Ein hoher Adrenalinspiegel korreliert bei unbelasteten Personen mit schnelleren Entscheidungen, weniger Fehlern in kognitiven Tests, ein verringerter Adrenalinspiegel mit langsameren Entscheidungen und höheren Fehlerquoten.8
- Bei einer langweiligen, unterstimulierenden Aufgabe schnitten (unbelastete) Probanden mit höheren Adrenalinspiegeln besser ab als diejenigen mit niedrigeren Adrenalinspiegeln. Bei einer fordernden, überstimulierenden Aufgabe schnitten dagegen die Probanden mit einem niedrigeren Adrenalinspiegel besser ab.8
- Junge Männer (Altersschnitt 24), die auf Stress einen höheren Noradrenalin- und Adrenalinanstieg zeigten, waren in Tests effizienter. Dieser Effekt war bei Adrenalin noch stärker als bei Noradrenalin.9
- Probanden, bei denen bei einem Aufmerksamkeitstest der Adrenalinspiegel im Vergleich zur Wartezeit anstieg, erzielten bessere Ergebnisse.10
- Kinder, deren Adrenalinspiegel während eines arithmetischen Tests im Vergleich zu einer passiven Situation zunahm, schnitten im Test besser ab als Kinder, die nicht mit einem Adrenalinanstieg reagierten.11
- Die subjektive Wahrnehmung von Stress korreliert bei gesunden Probanden linear mit der Höhe des Adrenalinspiegels.12
- Der Adrenalinspiegel (nicht aber der Noradrenalinspiegel) in Stresssituationen verringert sich tendenziell mit dem Gefühl der Kontrolle und Steuerungsfähigkeit der Betroffenen.13
- Die Adrenalinausschüttung der sympathetischen Nebenniere ist bei Kindern mit Aggressivität, motorischer Unruhe und Konzentrationsschwierigkeiten unter Stressbelastung wie ohne Stressbelastung signifikant verringert. Hyperaktive Jungen weisen unter Stress wie außerhalb Stressbelastung eine signifikant geringere Adrenalinausschüttung auf als Nichtbetroffene. Eine niedrige sympathisch-adrenale Reaktivität wird als Risikofaktor und Anfälligkeitsindikator für soziale und / oder tiefgreifende Verhaltensstörungen diskutiert.14
- Personen mit depressiven Tendenzen zeigen eine geringere Adrenalinstressantwort auf akuten Stress als Nichtbetroffene.15
7.2. Parasympathikus überhöht und unflexibel
Eine kleine Studie fand bei unmedikamentierten Kindern mit ADHS:16
- ein erhöhtes Arousal des Parasympathikus
- Methylphenidat verschob das autonome Gleichgewicht von Kindern mit ADHS in Richtung normaler Werte, erreichte die Vergleichswerte Nichtbetroffener jedoch nicht
- MPH hemmt die normale Reaktion des autonomen Nervensystems auf eine kognitive Herausforderung.
- Methylphenidat scheint die normale Stressreaktion zu verändern / zu unterdrücken
Eine weitere Studie fand Unterschiede der parasympathischen Aktivität (PRS) bei Kindern mit ADHS.17
Kinder mit ADHS zeigten eine unflexible, jeweils gleich starke Erhöhung der PRS bei
- negativen Emotionen
- positiven Emotionen
- Suppression einer Tätigkeit
- Induktion einer Tätigkeit
Kinder ohne ADHS zeigten dagegen bei
- negativen Emotionen: PRS stärker erhöht
- positiven Emotionen: PRS schwächer erhöht
- Suppression einer Tätigkeit: PRS stärker erhöht
- Induktion einer Tätigkeit: PRS schwächer erhöht
Eine Replikationsstudie bestätigte das starre Muster der erhöhten PRS bei Kindern mit ADHS, und fand zudem eine erhöhte Sympathikus-Reaktion. Die Veränderungen des Sympathikus bei ADHS korrelierten mit Störungen der Emotionsreaktivität, die Abweichungen des Parasympathikus mit Störungen der Emotionsregulation.18
Eine Studie an Kindern mit und ohne ADHS fand keine durchschlagenden Unterschiede der Ruheaktivität oder Reaktivität der respiratorischen Sinusarrhythmie (RSA). Unabhängig vom ADHS-Status korrelierten jedoch jeweils miteinander:19
- verringertes prosoziales Verhalten mit
- niedrigerer RSA-Wert in Ruhe
- geringerer reaktiver RSA-Rückgang
- Emotionsregulationsprobleme mit
- erhöhter reaktiver RSA-Rückgang auf Anreize.
Die respiratorische Sinusarrhythmie (RSA) besteht aus oszillatorischen Erhöhungen und Senkungen der Herzfrequenz während des Atemzyklus. Sie repräsentiert parasympathische / vagale Wirkungen auf das Herz. Die RSA soll den neuronalen Verkehr durch den Vagusnerv repräsentieren20. Der Vagusnerv soll einen physiologischen Mechanismus für die schnelle Beschleunigung und Verlangsamung der Herzleistung als Reaktion auf (auch soziale) Umweltanforderungen darstellen.21
7.3. Befunde zu Sympathikus bei ADHS uneinheitlich
Die kardiale Prä-Ejektions-Periode (PEP) ist ein durch das sympathische Nervensystem (SNS) vermitteltes systolisches Zeitintervall, das die Depolarisation des linken Ventrikels bis zum Beginn des Blutausstoßes in die Aorta umfasst (die Zeit vom Beginn der elektrischen Stimulation des linken Ventrikels (Beginn der Q-Zacke im EKG) bis zur Öffnung der Aortenklappe). Die PEP repräsentiert die mesolimbische Dopamin-Reaktivität insbesondere während der Belohnungsreaktion.22 Eine längere PEP ist ein Marker für eine verringerte Aktivität des Sympathikus, auch wenn dies noch von weiteren Faktoren mitbestimmt werden kann.23
7.3.1. Abgeschwächter Sympathikus: 2 Studien
Eine Untersuchung an 2.209 Teilnehmern fand eine Korrelation zwischen Unaufmerksamkeit und einer verlängerten Präejektionsperiode (PEP), was auf einen abgeschwächten Sympathikus in Bezug auf Unaufmerksamkeit hindeutet.24 Eine kleine Studie fand bei unmedikamentierten Kindern mit ADHS ebenfalls ein Underarousal des Sympathikus.16
7.3.2. Sympathikus unverändert: 2 Studien
Eine Studie fand keine Abweichungen des Sympathikus bei ADHS.17
Eine Studie an Kindern mit und ohne ADHS fand keine durchschlagenden Unterschiede der Ruheaktivität oder Reaktivität der kardialen Präejektionsperiode (PEP). Unabhängig vom ADHS-Status korrelierten jedoch jeweils miteinander:19
- Verhaltensprobleme und Aggressionen mit
- verlängerter PEP in Ruhe
- verringerter PEP-Reaktivität auf Anreize
Sympathikus erhöht:
Eine weitere Studie fand dagegen eine erhöhte Sympathikus-Reaktion bei Kindern mit ADHS. Die Veränderungen des Sympathikus bei ADHS korrelierten mit Störungen der Emotionsreaktivität, die Abweichungen des Parasympathikus mit Störungen der Emotionsregulation.18
7.3.3. Sympathikus erhöht: 2 Studien
Bei ADHS ist die HRV verringert und der Sympathikus überaktiviert.25 Zusammen mit einer verringerten kardialen (“cardiac-linked”) parasympathischen Aktivität und der verringerten HRV sei dies ein nichtinvasiver Marker für eine präfrontale Hypoaktivität und ADHS.26
Weitere Studien fanden Hinweise auf einen erhöhten Sympathikus bei komorbiden externalisierenden Störungen
Eine Studie fand bei Jugendlichen mit ADHS mit und ohne komorbide Conduct Disorder eine signifikante Verringerung der elektrodermalen Aktivität, was sich mit dem geringeren Angstempfinden bei Impulsivität deckt. Eine abgeschwächte PEP-Reaktion auf Belohnung fand sich nur bei Jugendlichen mit ADHS und komorbider Conduct Disorder, nicht bei ADHS allein.27 Weitere Studien deuten ebenfalls darauf hin, dass eine verringerte Belohnungsreaktivität des mesolimbischen dopaminergen Systems sich in abgeschwächten PEP-Signalen auf Belohnung zeigt und besonders mit aggressivem externalisierenden Verhalten korreliert.282930
Zwei Studien, die eine verringerte Herzratenvariabilität auf Belohnungen bei ADHS feststellten, differenzierten nicht zwischen ADHS und komorbiden externalisierenden Störungen.3132
8. Veränderungen des vegetativen Nervensystems durch ADHS-Medikamente
Eine Studie an Jugendliche mit ADHS fand eine verringerte Aktivität des Sympathikus und des Parasympathikus im Verglich zu Nichtbetroffenen. Dieser Unterschied wurde durch ein retardiertes MPH-Präparat nahezu egalisiert.33
9. Parasympathikus / Sympathikus bei anderen Störungsbildern
Borderline-Persömlichkeitsstörung zeigte mit und ohne komorbides ADHS einen erhöhten Sympathikustonus, der sich in größeren Pupillen als bei den Kontrollpersonen zeigte.34
Bellato, Arora, Hollis, Groom (2019): Is autonomic nervous system function atypical in Attention Deficit Hyperactivity Disorder (ADHD)? A systematic review of the evidence. Neurosci Biobehav Rev. 2019 Nov 10. pii: S0149-7634(19)30418-X. doi: 10.1016/j.neubiorev.2019.11.001. ↥
Wolf, Calabrese (2020): Stressmedizin & Stresspsychologie, S. 73 ↥ ↥
Ulrich-Lai, Herman (2009): Neural Regulation of Endocrine and Autonomic Stress Responses; Nat Rev Neurosci. 2009 Jun; 10(6): 397–409.; doi: 10.1038/nrn2647 ↥ ↥
Ramos, Arnsten (2007): Adrenergic pharmacology and cognition: focus on the prefrontal cortex. Pharmacol Ther. 2007 Mar; 113(3):523-36., Kapitel 6 ↥
Nater, Rohleder (2009): Salivary alpha-amylase as a non-invasive biomarker for the sympathetic nervous system: current state of research. Psychoneuroendocrinology 2009;34(4):486–96. ↥
Nater, Rohleder, Gaab, Berger, Jud (2005): Human salivary alpha-amylase reactivity in a psychosocial stress paradigm. Int J Psychophysiol 2005;55(3):333–42. ↥
Geiss L, Stemmler M, Beck B, Hillemacher T, Widder M, Hösl KM. Dysregulation of the autonomic nervous system in adult attention deficit hyperactivity disorder. A systematic review. Cogn Neuropsychiatry. 2023 Sep 13:1-22. doi: 10.1080/13546805.2023.2255336. PMID: 37702351. METASTUDY, k = 15, n = 846 ↥
Frankenhaeuser (1971): Behavior and circulating catecholamines. Brain Research, 31(2), 241-262. http://dx.doi.org/10.1016/0006-8993(71)90180-6 ↥ ↥
Frankenhaeuser, Mellis, Rissler, Bjorkvall, Patkai (1968): Catecholamine excretion as related to cognitive and emotional reaction patterns, Psychosom, Med., 30 (1968) 109-120., n = 25 ↥
Frankenhaeuser, Nordheden, Myrsten, Post (1970): Psychophysiological reactions to understimulation and overstimulation, Department of Psychology Research Report, 36. Stockholm: University of Stockholm, (1970) No. 316., zitiert nach Frankenhaeuser (1971): Behavior and circulating catecholamines. Brain Research, 31(2), 241-262. http://dx.doi.org/10.1016/0006-8993(71)90180-6, Seite 252 ↥
Johanssson (1970): Katekolaminutsiöndring och beteende hos barn, (Catecholamine release and behavior in children), unpublished thesis, Univ. Stockholm, (1970), zitiert nach Frankenhaeuser (1971): Behavior and circulating catecholamines. Brain Research, 31(2), 241-262. http://dx.doi.org/10.1016/0006-8993(71)90180-6, Seite 252 ↥
Frankenhaeuser, Sterky, Jarpe (1962): Psychophysiological relations in habituation to gravitational stress, Percept. mot. Skills, 15 (1962) 63-72. ↥
Frankenhaeuser, Rissler (1970): Effects of punishment on catecholamine release and efficiency of performance, Psychopharmacologia (Berl.), 17 (1970) 378-390. ↥
Klinteberg, Magnussen (1989): Aggressiveness and hyperactive behaviour as related to adrenaline excretion. Europ J Personality 3: 81-93 ↥
Frankenhaeuser, Patkai (1965): lnterindividual differences in catecholamine excretion during stress, Scand. J. Psychol., 6 (1965) 117-123. n = 110 ↥
Negrao, Bipath, van der Westhuizen, Viljoen (2011): Autonomic correlates at rest and during evoked attention in children with attention-deficit/hyperactivity disorder and effects of methylphenidate. Neuropsychobiology. 2011;63(2):82-91. doi: 10.1159/000317548. PMID: 21178382. n = 37 ↥ ↥
Musser, Backs, Schmitt, Ablow, Measelle, Nigg (2011, 2018): Emotion regulation via the autonomic nervous system in children with attention-deficit/hyperactivity disorder (ADHD). J Abnorm Child Psychol. 2011 Aug;39(6):841-52. doi: 10.1007/s10802-011-9499-1. Erratum in: J Abnorm Child Psychol. 2018 Jan 26;: PMID: 21394506; PMCID: PMC3112468. n = 66 ↥ ↥
Morris, Musser, Tenenbaum, Ward, Martinez, Raiker, Coles, Riopelle (2020): Emotion Regulation via the Autonomic Nervous System in Children with Attention-Deficit/Hyperactivity Disorder (ADHD): Replication and Extension. J Abnorm Child Psychol. 2020 Mar;48(3):361-373. doi: 10.1007/s10802-019-00593-8. PMID: 31808007; PMCID: PMC7720673. n = 259 ↥ ↥
Beauchaine, Gatzke-Kopp, Neuhaus, Chipman, Reid, Webster-Stratton (2013): Sympathetic- and parasympathetic-linked cardiac function and prediction of externalizing behavior, emotion regulation, and prosocial behavior among preschoolers treated for ADHD. J Consult Clin Psychol. 2013 Jun;81(3):481-493. doi: 10.1037/a0032302. PMID: 23544677; PMCID: PMC3952490. n = 99 ↥ ↥
[Ritz (2009): Studying noninvasive indices of vagal control: the need for respiratory control and the problem of target specificity. Biol Psychol. 2009 Feb;80(2):158-68. doi: 10.1016/j.biopsycho.2008.08.003. PMID: 18775468.](https://pubmed.ncbi.nlm.nih.gov/18775468/ ↥
Porges (2007): The polyvagal perspective. Biol Psychol. 2007 Feb;74(2):116-43. doi: 10.1016/j.biopsycho.2006.06.009. PMID: 17049418; PMCID: PMC1868418. REVIEW ↥
Brenner, Beauchaine (2011): Pre-ejection period reactivity and psychiatric comorbidity prospectively predict substance use initiation among middle-schoolers: a pilot study. Psychophysiology. 2011 Nov;48(11):1588-1596. doi: 10.1111/j.1469-8986.2011.01230.x. PMID: 21729103. ↥
Krohova, Czippelova, Turianikova, Lazarova, Tonhajzerova, Javorka (2017): Preejection period as a sympathetic activity index: a role of confounding factors. Physiol Res. 2017 Sep 22;66(Supplementum 2):S265-S275. ↥
Vogel, Bijlenga, Verduijn, Bron, Beekman, Kooij, Penninx (2017): Attention-deficit/hyperactivity disorder symptoms and stress-related biomarkers. Psychoneuroendocrinology. 2017 May;79:31-39. doi: 10.1016/j.psyneuen.2017.02.009. n = 2.209 ↥
Tonhajzerova, Farsky, Mestanik, Visnovcova, Mestanikova, Hrtanek, Ondrejka (2016): Symbolic dynamics of heart rate variability – a promising tool to investigate cardiac sympathovagal control in attention deficit/hyperactivity disorder (ADHD)? Can J Physiol Pharmacol. 2016 Jun;94(6):579-87. doi: 10.1139/cjpp-2015-0375. ↥
Sekaninova, Mestanik, Mestanikova, Hamrakova, Tonhajzerova (2019): Novel approach to evaluate central autonomic regulation in attention deficit/hyperactivity disorder (ADHD). Physiol Res. 2019 Aug 29;68(4):531-545. ↥
Beauchaine, Katkin, Strassberg, Snarr (2001): Disinhibitory psychopathology in male adolescents: discriminating conduct disorder from attention-deficit/hyperactivity disorder through concurrent assessment of multiple autonomic states. J Abnorm Psychol. 2001 Nov;110(4):610-24. doi: 10.1037//0021-843x.110.4.610. PMID: 11727950. ↥
Gatzke-Kopp, Beauchaine (2007): Central nervous system substrates of impulsivity: Implications for the development of attention-deficit/hyperactivity disorder and conduct disorder. In: Coch, Dawson, Fischer ( Eds): Human behavior, learning, and the developing brain: Atypical development. New York: Guilford Press; 2007. pp. 239–263; 247 ↥
Beauchaine, Gatzke-Kopp, Mead (2007): Polyvagal Theory and developmental psychopathology: emotion dysregulation and conduct problems from preschool to adolescence. Biol Psychol. 2007 Feb;74(2):174-84. doi: 10.1016/j.biopsycho.2005.08.008. PMID: 17045726; PMCID: PMC1801075. REVIEW ↥
Crowell, Beauchaine, Gatzke-Kopp, Sylvers, Mead, Chipman-Chacon (2006): Autonomic correlates of attention-deficit/hyperactivity disorder and oppositional defiant disorder in preschool children. J Abnorm Psychol. 2006 Feb;115(1):174-8. doi: 10.1037/0021-843X.115.1.174. PMID: 16492108. ↥
Crone, Jennings, van der Molen (2003): Sensitivity to interference and response contingencies in attention-deficit/hyperactivity disorder. J Child Psychol Psychiatry. 2003 Feb;44(2):214-26. doi: 10.1111/1469-7610.00115. PMID: 12587858. ↥
Iaboni, Douglas, Ditto (1997): Psychophysiological response of ADHD children to reward and extinction. Psychophysiology. 1997 Jan;34(1):116-23. doi: 10.1111/j.1469-8986.1997.tb02422.x. PMID: 9009815. ↥
Morris, Musser, Tenenbaum, Ward, Raiker, Coles (2021): Methylphenidate Improves Autonomic Functioning among Youth with Attention-Deficit/Hyperactivity Disorder. Res Child Adolesc Psychopathol. 2021 Oct 6. doi: 10.1007/s10802-021-00870-5. PMID: 34613513. ↥
Calancie OG, Parr AC, Brien DC, Huang J, Pitigoi IC, Coe BC, Booij L, Khalid-Khan S, Munoz DP (2023): Motor synchronization and impulsivity in pediatric borderline personality disorder with and without attention-deficit hyperactivity disorder: an eye-tracking study of saccade, blink and pupil behavior. Front Neurosci. 2023 Jun 22;17:1179765. doi: 10.3389/fnins.2023.1179765. PMID: 37425020; PMCID: PMC10323365. ↥
