Blut-Hirn-Schranke und ADHS
Die Blut-Hirn-Schranke ist eine Gruppe von Mechanismen, die das Blut von der Gehirnflüssigkeit trennt. Durch die Blut-Hirn-Schranke werden Blutgefäße im Gehirn sehr dicht gegen einen unkontrollierten Übertritt von Stoffen in das Gehirn geschützt. Der Austausch wird über Transporter und Vesikel kontrolliert.
Die Mechanismen der Blut-Hirn-Schranke sitzen in bzw. um die Endothelialzellen. Manche Mechanismen induzieren (Tight Junctions, Transporter, Stoffwechselenzyme) und andere hemmen (Transzytose, LAM) den Stoffaustausch.1
Dieselbe Schranke heißt am Rückenmark Blut-Rückenmark-Schranke.
Eine Verletzung der BHS korreliert mit der Anhäufung zahlreicher vaskulärer und neurotoxischer Moleküle im Hirnparenchym, einem verminderten zerebralen Blutfluss und Hypoxie.2
Eine grundlegende Einführung zur Blut-Hirn-Schranke in deutscher Sprache findet sich unter Psysiologie.cc3, in englischer Sprache bei Daneman, Prat.1
- 1. Bestandteile der Blut-Hirn-Schranke
- 1. Tight Junctions und ihre Proteine
- 2. Transporter durch die Blut-Hirn-Schranke
- 3. Transzytose (caveolinbasierter Vesikeltransport)
- 4. Leukozyten-Adhäsionsmoleküle (LAM)
- 5. Eigene Immunreaktion der Blut-Hirn-Schranke
- 6. Regulation der Blut-Hirn-Schranke
- 7. Funktionsstörungen der Blut-Hirn-Schranke
- 8. Umgehung der Blut-Hirn-Schranke
- 8. Blut-Hirn-Schranke bei verschiedenen Störungsbildern
1. Bestandteile der Blut-Hirn-Schranke
Die wichtigsten Elemente der BHS sind:
- Basalmembran
- Endothelialzellen
- liegen innen an der Basalmembran der Kapillar-Blutgefäßen des Gehirns
- werden durch Tight Junctions eng miteinander verbunden
- umschließen das Lumen (Hohlraum, durch den das Blut fließt)
- Perizyten
- Perizyten umschließen die Basalmembran der Kapillaren von außen
- sind vom Virchow-Robin-Raum umgeben
- Unterbrechungen der Perizytenabdeckung erhöhen die unspezifische Transzytose in den Zellen und die Expression von Leukozytenadhäsionsmolekülen. Beitrag zu neurologischen Erkrankungen offen.
- Astrozyten-Fortsätze
- stützen die Kapillaren
- Unterbrechung der Astrozyten-Endfüße an der NVU verringert die glymphatische Clearance. Möglicher Beitrag zu pathologischer Anhäufung von Proteinen, einschließlich Aβ2
- Mikroglia
Die Summe aus Neuronen, Endothelzellen und Astrozyten in der BHS wird neurovaskuläre Einheit (NVU) genannt..
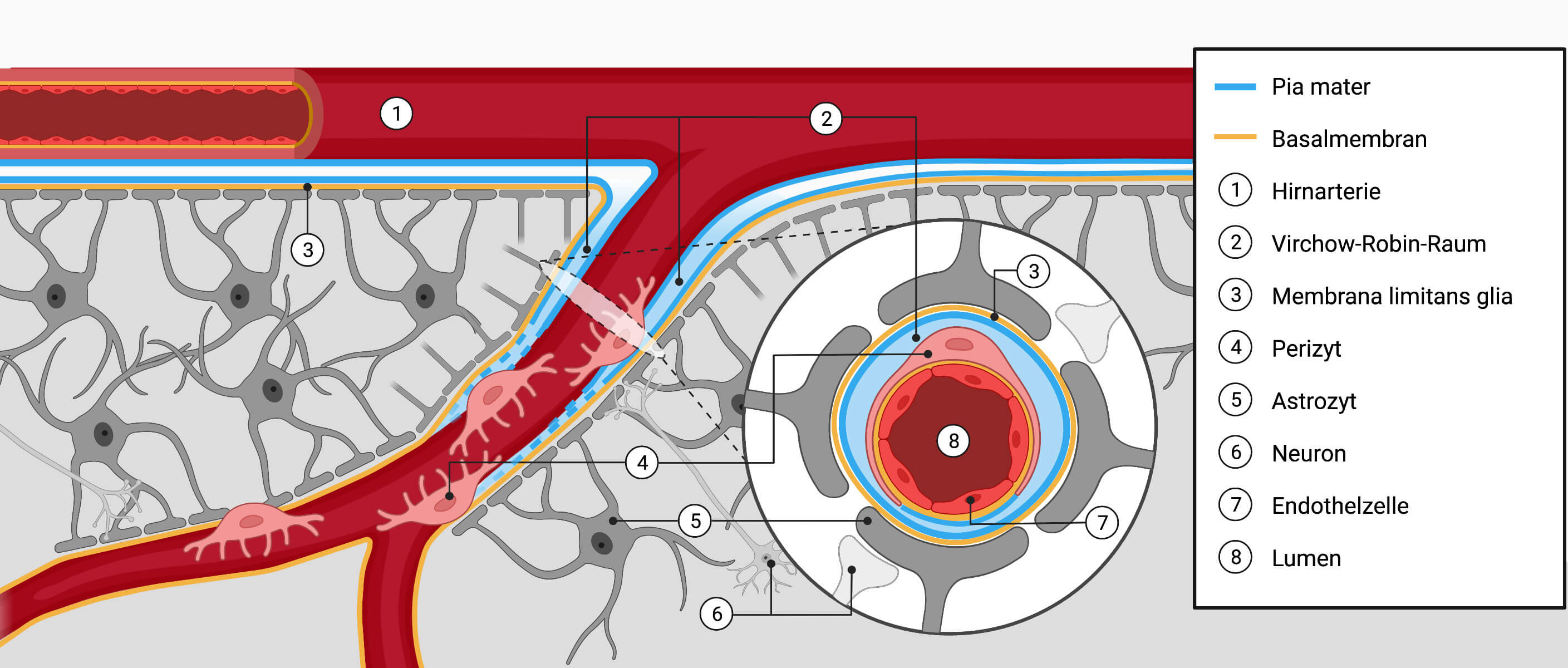
Bildautor: Janica Nolte, DocCheck, erstellt mit BioRender.com; lizenziert unter CC BY-NC-SA 3.0; Quelle:DocCheck Flexikon: Schematische Darstellung der Hirngewebsschichten und -gefäße
1. Tight Junctions und ihre Proteine
Tight Junctions (lat.: Zonula occludens) sind Mechanismen, die Gehirn-Endothelialzellen über Tight-Junctions-Proteine mit dem Zytoskelett verankern, was die Zellstruktur stabilisiert. Dadurch bilden die Endothelialzellen eine dichte Barriere.
Dies verhindert, dass Stoffe an den Endothelialzellen vorbei aus dem Blut in die Gehirnflüssigkeit übertreten.
Tight Junctions minimieren die Diffusion aus dem Blutgefäß an den Endothelialzellen vorbei. Diese Diffusion stellt ein Maß der Integrität der BHS dar und kann mit dem transendothelialen elektrischen Widerstand (TEER) gemessen werden. TEER liegt in der BHS bei 1.500 bis 2.000 Ω/cm2 und ist damit 50- bis 500-mal höher als in peripheren Blutgefäßen (dort 3 bis 30 Ω/cm2).
(1.500-2.000 im Vergleich zu 3-30 Ω/cm2).4
Neben Tight Junctions gibt es als weitere Zellkontakte die Adhäsionskontakte und Gap Junctions. Letztere sind Kommunikationsverbindungen, die Zellen elektrisch miteinander koppeln.
Tight Junctions bilden im Darm losere, im Gehirn dichtere Verbindungen.
Sie finden sich jedoch nicht nur in Epithelien und Endothelien, sondern auch in myelinisierten Zellen. Axone werden durch eine lockere Spirale von Oligodendrozyten und Schwann-Zellen umhüllt. Diese multilamellare Struktur isoliert das Axon elektrisch und ermöglicht eine saltatorische Reizweiterleitung. Die Tight Junctions zwischen Glia und Axonen sowie innerhalb der Myelinscheiden enthalten Proteine, wie sie auch in den Tight Junctions von Epithelien und Endothelien zu finden sind.5
Tight Junctions bestehen aus transmembranen Proteinen wie:5
- Claudine
- Occludine
- Tetraspanin
- JAM (junctional adhesion molecule, funktionelles Adhäsionsmolekül)
- CAR
- Protein 0 (P0)
- OSP/claudin 11
- PMP22/gas-3
- OAP-1/TSPAN-3
- ZO-1
- ZO-2
- ZO-3
- Pals1
- MAGI-1/BAP-1
- MAGI-2
- MAGI-3
- PAR-Proteine
- MUPP1
- AF-6/Afadin
- PATJ
- Cingulin
- Symplekin
- 7H6 antigen/barmoti
- Rab proteine
- Pilt
- JEAP
- huASH1
- Heterotrimere G-Proteine
- ICAM, Interzelluläres Adhäsionsmolekül2
2. Transporter durch die Blut-Hirn-Schranke
An der Aufnahme in und der Ausscheidung aus dem Organismus sowie dem Übertritt von Medikamenten aus dem Blut in das Gewebe sind Transportproteine beteiligt.
2.1. Efflux-Transporter
Efflux-Transporter nutzen die Hydrolyse von ATP, um ihre Substrate über den Konzentrationsgradienten zu transportieren. Viele dieser Transporter sind an der Lumenoberfläche lokalisiert und transportieren eine breite Palette von Substraten in das Blut:1
- P-Glykoprotein (MDR1-Gen): kontrolliert den Transfer von Arzneistoffen in das Gehirn
- MDR1-Genvarianten beeinflussen dessen Wirksamkeit. Herabgesetzte MDR1-Funktion schwächt Blut-Hirn-Schranke, Arzneistoffe können vermehrt ins Gehirn übertreten, was deren Wirkung erhöhen kann, obwohl der Blutplasmaspiegel unverändert ist.6
- BCRP, Brustkrebs-Resistenzprotein
- MRP, Multidrug-Resistenz-assoziiertes Protein
2.2. Nährstofftransporter
Nährstofftransporter erleichtern die Bewegung bestimmter Nährstoffe entlang ihres Konzentrationsgradienten:1
- Solute-Carrier-Transporter
- GLUT1 (Glukose-Transporter 1, SLC2a1): Glukose
- SLC16a1: Laktat, Pyruvat
- SLC7a1: kationische Aminosäuren
- LAT1 (Large Neutral Amino Acid Transporter 1, SLC7a5): neutrale Aminosäuren (Phenylalanin, Tyrosin, Tryptophan), L-DOPA (nicht-proteinogene α-Aminosäure), Verzweigtkettige Aminosäuren (BCAAs)7
- bildet ein Heterodimer mit dem Glykoprotein CD98, das durch das SLC3A2-Gen kodiert wird
- BCAAs werden in das sich entwickelnde Gehirn in viel höherem Maße transportiert als im Erwachsenenalter
- SLC7A5 scheint als Antiporter zu funktionieren und Histidin scheint die wichtigste Gegenaminosäure zu sein
- SLC7A5 erleichtert nicht den Transport von Neurotransmittern
- Rezeptorvermittelte Transportsysteme
- Transferrinrezeptor: Transferrin/Eisen
- Ager: Amyloid
- LRP1/LRP8
2.3. Konkurrenz um Transporternutzung
Eine Konkurrenz verschiedener Stoffe hinsichtlich des Transports durch die Hirnschranke kann die Wirkung von Medikamenten beeinflussen.
Beispiel: Memantin, Opiate (Oxycodon, Codein), Tramadol, Kokain und Nikotin werden mittels derselben Transporterfamilie (Organischer Kationentransporter, OCT) durch die Blut-Hirn-Schranke transportiert. Da OCT einer Sättigungsgrenze unterliegen, könnte dieser gemeinsame Transportmechanismus den Memantin-Spiegel im Gehirn und damit dessen Wirkung beeinflussen.8
Eine Betroffene berichtete uns, dass ihr die Gabe von Memantin gut gegen ihre ADHS-Symptome half.
Bei der SHR, dem meistuntersuchten ADHS-Modelltier, ist die Expression des Laktattransporters Monocarboxylat-Transporter 1 (MCT1) an der Blut-Hirn-Schranke im Hippocampus erhöht. Die Autoren hypothetisieren, dass Hyperaktivität aufgrund der durch Bewegung erhöhte Laktatproduktion in Skelettmuskeln eine Reaktion sein könnte, um eine verringerte Versorgung durch Astrozyten auszugleichen.9
3. Transzytose (caveolinbasierter Vesikeltransport)
In den Endothelialzellen des Gehirns ist die Transzytoserate drastisch niedriger als peripheren Geweben. Bei Verletzungen oder Krankheiten wird die Transzytose hochreguliert und stellt dann die größte Schwachstelle der Blut-Hirn-Schranke dar.
Caveolin-1 wird von allen Eizellen exprimiert und ist nach traumatischen Hirnverletzungen in der Blut-Hirn-Schranke hochreguliert. Ebenso wird das Plasmalemma-Vesikel-assoziierte Proteins (PLVAP) bei einer Reihe von Krankheiten, bei denen es zu einer Undichtigkeit der Blut-Hirn-Schranke kommt, hochreguliert.1
4. Leukozyten-Adhäsionsmoleküle (LAM)
Leukozyten binden über die auf ihrer Oberfläche vorhandenen Adhäsionsmoleküle LFA-1, Mac-1 oder CR4 an die entsprechenden Adhäsionsmoleküle der Endothelzellen. Danach treten die Leukozyten durch das Endothel hindurch und wandern in das umliegende Gewebe aus (Leukozytenmigration).10
LAM sind in Gehirn-Endothelialzellen sehr viel seltener als in Endothelialzellen des Körpers. Neuroinflammatorische Erkrankungen wie Schlaganfall und MS erhöhen jedoch die LAM im ZNS über das hilfreiche Maß hinaus.
Je nach Krankheit infiltrieren andere Untergruppen von Entzündungszellen das Gehirn:1
- MS
- Lymphozyten
- T-Zellen
- B-Zellen
- Neutrophile
- Makrophagen
- Lymphozyten
- Schlaganfall
- Neutrophile
- Makrophagen
- kaum jedoch Lymphozyten
Der für die Bekämpfung von Infektionen grundsätzlich erforderliche Transport der Leukozyten ist bei MS deutlich überhöht.
Um pathologische Entzündungen gezielt zu bekämpfen, ohne die Patienten anfälliger für Infektionen zu machen, sollten nur die jeweiligen Leukozyten-Adhäsionsmoleküle gehemmt werden, die die Extravasation der jeweiligen Untergruppe von Immunzellen erleichtern:2
- NINJ1 (Ninjurin1): Monozyten
- ALCAM (Activated Leukocyte Cell Adhesion Molecule): CD4+ T-Zellen, Monozyten
- ALCAM ist auch für Tight Junctions erforderlich, ALCAM-KO-Mäuse zeigen schwere experimentelle Autoimmun-Enzephalomyelitis11
Dies zeigt, dass nur eine Hemmung und keine Ausschaltung hilfreich sein kann.
- ALCAM ist auch für Tight Junctions erforderlich, ALCAM-KO-Mäuse zeigen schwere experimentelle Autoimmun-Enzephalomyelitis11
- JAML (Junctional Adhesion Molecule-Like, or AMICA1): Monozyten, CD8+ T-Zellen
- MCAM (Melanoma cell adhesion molecule); CD8, T-Helferzellen 17
5. Eigene Immunreaktion der Blut-Hirn-Schranke
Die BHS schützt nicht nur die Gehirnzellen vor peripheren Einflüssen, sondern fördert auch aktiv die Neuroinflammation, indem sie Immunreaktionen bei Autoimmunangriffen auf das ZNS steuert.
Gehirn-Endothelialzellen können verschiedene Stoffe ausschütten:1
- proinflammatorische Chemokine
nötig sind, um Lymphozyten und Monozyten in das Gehirn zu führen:- CCL2
- CCL5
- CXCL10
- proinflammatorische Zytokine
regulieren die Expression von proinflammatorischen Mediatoren hoch und beeinflussen die Expression von Junktion-Proteinen und setzen damit die Durchlässigkeit der BHS herab- IL-17
- IL-22
- Granulozyten-Makrophagen-Kolonie-stimulierender Faktor (GM-CSF)
- Interferon (IFN)-γ
- TNF (Tumornekrosefaktor)
- interzelluläre Adhäsionsmoleküle
vermitteln (zumindest teilweise( den Adhäsionsprozess und die Transmigration von Leukozyten und Leukozyten-Subtypen zum ZNS vermitteln- ICAM-1
- ICAM-2
- vaskuläre CAM (VCAM)-1
- aktivierte Leukozyten-CAM (ALCAM)
- Melanom-CAM (MCAM)
- Ninjurin-1
6. Regulation der Blut-Hirn-Schranke
Signalwege und Transkriptionsfaktoren können unterschiedlich auf de BHS wirken:1
6.1. Förderung der BHS-Barriere
Die BHS-Barriere wird gefördert durch:
- WNT (wichtig)
- Bindung an Frizzled/LRP5/6 aktiviert β-Catenin, was Expression und Ausrichtung der Junktionsproteine Claudin-3 und p120 auf die Zellmembran bewirkt
- Ein Verlust des WNT-Korezeptors LRP5 verringert die Claudin-5-Expression
- Hedgehog (wichtig)
- steuert die Transkription und Expression von Junktionsproteinen
- dämpft Entzündungsreaktionen auf Endothelialzellen des Gehirns
- SOX-18
- steuert die Claudin-5-Expression
- wird aktiviert durch GLI1, das seinerseits durch Hedgehog-Liganden oder WNT aktiviert wird
- NR2F2 (Nuclear Receptor Subfamily 2 Group F Member 2)
- wird durch Hedgehog-Liganden oder WNT induziert
- fördert die Expression von ANG-1 fördert
- induziert die Expression von Junktionsproteinen durch TIE-2
- verringert die Expression von ANG-2
- da ANG2 die Expression von Junktionsproteinen verringert, wirkt NR2F2 auch dadurch mittelbar erhöhend auf Junktionsproteine
- aktiviert durch oxidativen Stress Antioxidant Response Elements (ARE)
- ARE stabilisieren die Expression von ZO-1, Occludin und Claudin-5
- schützt Endothelialzellen des Gehirns bei Verletzungen durch Unterdrückung der Expression von Entzündungsgenen
- ERG
- NKX2-1
- SP3/YY1
6.2. Verringerung der BHS-Barriere
Die BHS-Barriere wird verringert durch:
- NF-κB
- Snail
- Bakterielle Induktion von Snail1 trägt zur Störung der Blut-Hirn-Schranke bei12
- Snail wird durch β-Catenin gehemmt
- dies verringert die Stabilität von p120/VE-Cadherin-Komplexen und die Expression der Tight Junction Moleküle Occludin und Claudin-5
- FOXO1
- PKC
- eNOS
Die Blut-Hirn-Schranke wird unter anderem durch perivaskuläre Zellen reguliert, die Blutgefäße von innen auskleiden. Dazu gehören Perizyten und Astrozyten.
Perizyten scheinen nicht an der Entstehung der BHS bzw. ihrer spezifischen Eigenschaften wie Tight Junctions oder Transportern beteiligt zu sein, hemmen jedoch Faktoren, die mit undichten peripheren Gefäßen in Verbindung gebracht werden, wie Transzytose oder LAM.1
Astrozyten beeinflussen die Form von Endothelialzellen, die Entstehung neuer Blutgefäße aus bestehenden Blutgefäßen (Angiogenese) und den Phänotyp der Blut-Hirn-Schranken-Barriere unter physiologischen und pathologischen Bedingungen.13
Astrozyten produzieren Faktoren, die die endotheliale Funktion während der Entwicklung und im Erwachsenenalter beeinflussen.
- VEGF, vaskulären endothelialen Wachstumsfaktor. VEGF wirkt141
- VEGF-Familie umfasst
- VEGF-A, VEGF-B, VEGF-C, VEGF-D, VEGF-E, PlGF
- bindet an spezialisierte Tyrosin-Rezeptorkinasen, VEGF-Rezeptor-1, VEGFR-2, Neuropilinen
- während Entwicklung
- angiogen: fördert Bildung, Umbau und Überleben embryonaler Blutgefäße
- neurotropher Faktor
- im Erwachsenenalter
- bei Entzündungen verringert VEGF Stabilität der BHS
- 17β-Östradiol behob die durch VEGF verursachte Erhöhung der BHS-Durchlässigkeit1516
- VEGF moduliert die Migration von Oligodendrozyten-Vorläuferzellen (OPCs). OPCs unterstützen die Integrität der reifen Blut-Hirn-Schranke.14
- niedriges VEGF korrelierte mit der Symptomschwere von ASS, jedoch nur bei Frauen17
- VEGF-Familie umfasst
- Hedgehog-Signalkaskade1
Beteiligt an embryonaler Morphogenese, neuronalen Steuerung und Angiogenese; induziert Thight Junction Proteine- Astrozyten sezernieren Sonic Hedgehog
- Endothelialzellen exprimieren
- Hedgehog-Rezeptor Patched-1
- Smoothened (SMO), einen Signalüberträger
- SMO-KO-Mäuse zeigten erhöhte Durchlässigkeit der Blut-Hirn-Schranke
- Transkriptionsfaktoren der GLI-Familie
- Angiopoietine. Angiopoetine sind Wachstumsfaktoren, die die Einsprossung von Blutgefäßen in Gewebe, die Angiogenese, steuern1
- ANG1: beteiligt an
- BHS-Differenzierung durch Förderung der Angiogenese
- zeitabhängige Hemmung der endothelialen Permeabilität mittels Erhöhung Junktionsprotein-Expression
- Erhöhung der BHS-Barrierefunktion bei gleichzeitiger Exprimierung mit VEGF
- ABG-2: beteiligt an
- Abbau der BHS bei Verletzungen und Krankheiten
- ANG1: beteiligt an
- ACE-1, Angiotensin-Converting-Enzym-11
- verwandelt Angiotensin I in Angiotensin II
- wirkt auf Angiotensin-AT1-Rezeptoren, die von den BHS-Elementen exprimiert werden
- Angiotensin I verringert Permeabilität der BHS ein und stabilisiert die Funktion der Junktionsproteine, indem es ihre Rekrutierung in Lipid Rafts fördert.
- Angiotensin II bewirkt Verengung der Gefäße und fördert Tight Junction Bildung
- Angiotensin-defiziente Mäuse zeigen veränderte Expression von Occludin an der BHS
- TGF-β, Transforming growth factor β1 ist ein Zytokin, das an Zellwachstum, Differenzierung, Morphogenese, Apoptose und Immunmodulation beteiligt ist
- wird von Astrozyten und Gehirn-Endothelialzellen sezerniert
- neuroprotektive Wirkung im Gehirn
- kann MDR1-Aktivität induzieren und BHS-Durchlässigkeit verringern
- verringert die Leukozyten-Transmigration durch das Endothel
- Retinsäure1
- wird von Astrozyten und radialen Gliazellen sezerniert
- Rezeptor: RA-Rezeptor β (RAR-β) wird in der sich entwickelnden Vaskulatur exprimiert
- RAR-β-Aktivierung erhöht TEER, was mit erhöhter Expression von VE-Cadherin, P-gp und ZO-1 korreliert
- RA moduliert die Hedgehog-, Wnt- und FGF-Signalwege
7. Funktionsstörungen der Blut-Hirn-Schranke
Eine BHS-Dysfunktion ist bei manchen Krankheiten (z.B. MS, Epilepsie und Schlaganfall) ein zentrales Element der Pathologie.
Bei anderen Störungsbildern (z.B. Alzheimer und ASS) wird die Bedeutung einer BHS-Funktionsstörung diskutiert.
Eine Störung der Blut-Hirn-Schranke bewirkt
- Dysregulation der Ionen
- Ödeme
- Neuroinflammation
Dies kann zu neuronaler Dysfunktion, erhöhtem Hirndruck und neuronaler Degeneration führen.2
Die Blut-Hirn-Schranke ist kein einheitliches Gebilde im Sinne einer physischen Wand, die bei einem „BHS-Durchbruch“ zerstört wäre.
Die BHS ist vielmehr das Ergebnis des Zusammenwirkens einer Reihe von physiologischen Eigenschaften. Die Veränderung nur einer Eigenschaft (Transzytose, Transport) kann die neuronale Umgebung erheblich verändern.
Je nachdem, welcher Teil der BHS beeinträchtigt ist, können daraus andere Störungsbilder entstehen. Störungspfade können sein:2
- GLUT1-Glukosetransport
- LAT1-Aminosäuretransport
- ASS7
- MCT8-Schilddrüsenhormontransport
- psychomotorische Retardierung20
- VEGF-A, vaskulärer endothelialer Wachstumsfaktor
- MS21
- entzündliche Zytokine
- Tumornekrosefaktor α
- Interleukine 1 und 6
- Schädel-Hirn-Trauma22
- reaktive Sauerstoffspezies
- Matrixmetalloproteinasen
- Wnt-Signalübertragung
Die Extravasation von Leukozyten erfolgt über einen aktiven Trafficking-Prozess.2
Es bestehen viele Untergruppen von Immunzellen mit unterschiedlichen Rollen bei der Neuroinflammation:
- Parenchymale ECs regulieren Leukozyten-Adhäsionsmoleküle hoch und erhöhen so den Leukozyten-Traffic
- P-Selektin und E-Selektin vermitteln das Rollen von Leukozyten entlang des Endothels
- ICAM1 und VCAM1 vermitteln eine feste Adhäsion
- Die Spiegel von ICAM1- und PECAM1 können beeinflussen, ob die Extravasation von Leukozyten über die BHS transzellulär oder parazellulär erfolgt.
- Proteine wie PLVAP helfen bei der Transmigration durch die ECs
- PLVAP sind bei Krankheiten ebenfalls hochreguliert
8. Umgehung der Blut-Hirn-Schranke
Die Blut-Hirn-Schranke erschwert es Medikamenten sehr, Ziele im Gehirn zu erreichen. Ein möglicher Weg, dies zu umgehen, ist die Verabreichung von Arzneimitteln über die Nase zum Gehirn mittels Nanoformulierung. Die Medikamente gelangen so in die Nasenhöhle und von dort über Verbindungen zwischen den Riech- und Trigeminusnerven und der Nasenschleimhaut ins Gehirn.23
Eine intranasale Dopamin-Gabe verringerte Hyperaktivität und verbesserte Aufmerksamkeit bei Naples High Excitability Ratten, einem ADHS-Modelltier.24
8. Blut-Hirn-Schranke bei verschiedenen Störungsbildern
8.1. Blut-Hirn-Schranke und ADHS
Bei der SHR ist die Blut-Hirn-Schranke durch erhöhte Neuroinflammation und übermäßige Autophagie geschädigt. Im Gehirn von SHR fand sich:25
- die Anzahl Iba1-immunopositiver Mikroglia erhöht
- TNF-α erhöht
- im PFC und Hippocampus
- Autophagie von Zellen erhöht
- MMP2 erhöht
- MPP9 erhöht
- Zonula Occludens-1 (ZO-1, ein Tight Junction Protein) verringert
- Occludin (ein Tight Junction Protein) verringert
Eine Studie fand Hinweise auf eine verringerte Tryptophanaufnahme durch die Blut-Hirn-Schranke bei Jungen mit ADHS. Die Tyrosinaufnahme war unverändert.26
Zonulin steuert die Tight Junctions. Erhöhte Zonulin-Werte repräsentieren eine erhöhte Durchlässigkeit der Darmwand und der Blut-Horn-Achse.27
Eine Untersuchung an 40 ADHS-Betroffenen und 41 Nichtbetroffenen fand erhöhte Zonulin-Werte bei den ADHS-Betroffenen, wobei die erhöhten Zonulin-Werte zugleich mit der Hyperaktivität korrelierten,28 sodass eine höhere Verbindung zu ADHS-HI als zu ADHS-I bestehen könnte.
Weitere Studien fanden erhöhte Serum-Zonulin-, Occludin- und Claudin-5 Werte bei Kindern mit ADHS.293031 Alle drei beeinträchtigen die Blut-Hirn-Schranke.
Erhöhtes Zonulin korrelierte mit erhöhten sozialen Schwierigkeiten bei ADHS.32
Eine Studie fand leicht (nicht signifikant) verringerte Zonulin-Serum-Werte und leicht (nicht signifikant= erhöhte Occludin-Serumspiegel, wobei letztere mit einem Subtest des Conners’ continuous performance test korrelierten.33 Daneben fanden sich verringerte DEFA1-Spiegel bei Unaufmerksamkeit.33
Erhöhte Zonulin-Spiegel konnten durch eine Erhöhung von Bifidobacterium ausgeglichen werden.3435 Bifidobacterium wurde bei ADHS von manchen Studien als erhöht und von anderen verringert gefunden. Mehr hierzu unter Darm-Hirn-Achse und ADHS
Mehr zu Zonulin und dessen Wirkung:
⇒ Erhöhte Darmpermeabilität bei ADHS
8.2. Blut-Hirn-Schranke und ASS
Beeinträchtigungen des LAT1-Aminosäuretransporters können durch einen Mangel an Verzweigtkettige Aminosäuren (BCAAs) im Gehirn zu ASS führen.7
Der Large Neutral Amino Acid Transporter 1 (LAT1) wird durch das SLC7A5-Gen kodiert, ist an der Blut-Hirn-Schranke ansässig und bildet ein Heterodimer mit dem Glykoprotein CD98, das durch das SLC3A2-Gen kodiert wird.
BCAAs werden in das sich entwickelnde Gehirn in viel höherem Maße transportiert als im Erwachsenenalter.7
8.3. Blut-Hirn-Schranke und MS
Multiple Sklerose wird durch T-Zellen vermittelt, wobei CD4 T-Helfer (Th)-Zellen des Th17- und Th1-Phänotyps grundlegend involviert sind.1
Daneben spielen B-Zellen eine wichtige Rolle in der Immunpathogenese der MS, da
- die im Gehirn gebildeten Antikörper ein wesentliches Merkmal der Krankheit sind (d. h. oligoklonale Banden)
- auf B-Zellen gerichtete Therapien stark vor der Läsionsbildung schützen
Während der Infiltration durch Immunzellen und der Bildung von Läsionen ist die Blut-Hirn-Schranke beeinträchtigt, was sich durch vaskuläre Leckagen und Veränderungen der Junktionsproteine zeigt. Anomalien in der Expression von Junktionsproteinen gehen bei MS mit perivaskulärer Astrogliose einher. Solche Veränderungen werden in sehr frühen Stadien der Läsionsbildung festgestellt.1
Bei MS wird durch reaktive Astrozyten VEGF-A exprimiert, das in der Lage ist, durch Störung der Claudin-5- und Occludin-Expression den Zusammenbruch der BHS zu bewirken und das Eindringen von Immunzellen in das ZNS zu fördern.
VEGF-A bindet an den VEGFR2-Rezeptor auf den Gehirn-Endothelialzellen der BHS, was die eNOS-abhängige Herunterregulierung der Junktionsproteine Claudin-5 und Occludin auslöst, die zum Zusammenbruch der BHS führen.
Die Hochregulierung von VEGF-A scheint mittels IL-1 aus Mikroglia induziert zu werden.
In MS-Läsionen ist die Expression von AGT in Astrozyten und Occludin in Gehirn-Endothelialzellen verringert im Vergleich zu nicht betroffener weißer Substanz. Dies korreliert mit verringerter AGT-Expression in Astrozyten, die in vitro mit IFN-γ und TNF-α stimuliert wurden. AGT-defiziente Mäuse haben eine beeinträchtigte BHS-Funktion, die mit einer verringerten und gestörten Expression von Occludin korreliert.
Es gibt Arten von Läsionen, bei denen eine BHS-Durchlässigkeit initial ist, bei anderen folgt die Beeinträchtigung der BHS erst den Läsionen nach.36 Bei neuen Läsionen ist die BHS in der Regel funktional. Bei älteren Läsionen ist BHS fast immer beeinträchtigt.2
MS ist durch eine Infiltration des Gehirns durch Immunzellen geprägt, die zunächst in den perivaskulären Raum eindringen, der die postkapillären Venolen umgibt. Mit dem Überwinden der Basalen Lamina verschaffen sich die Immunzellen in großen Mengen Zugang zum Parenchym, indem Leukozyten Zytokine absondern, die auf den Gehirn-Endothelzellen die Expression von Leukozytenadhäsionsmolekülen auslösen.2
Die primären Orte der Immunkontrolle des Gehirns sind die Blut-CSF-Schranken des Plexus choroideus und der Meningen. Im MS-Nagetiermodell der Autoimmun-Enzephalomyelitis (EAE) sind beide wichtige Orte der anfänglichen Lymphozytenaktivierung.2
Natalizumab verhindert die Interaktion des α4-Integrin von Immunzellen mit dem endothelialen VCAM1. Dies hemmt den Transport von Immunzellen durch die BHS und reduziert so die Bildung neuer Läsionen erheblich.37
8.4. Blut-Hirn-Schranke und Epilepsie
Bei Epilepsie bestehen etliche Marker für eine Beteiligung der Blut-Hirn-Schranke:2
- Das MRT zeigt ein Leck in der Blut-Hirn-Schranke
- Im Gehirngewebe ist das parenchymale Albumin erhöht, was auf eine Extravasation großer Moleküle vom Blut ins Gehirn hindeutet
- GLUT1 ist regional verringert, Glukose-Aufnahme und Glukosestoffwechsel in Anfallsherden sind verringert
Eine Störung der BHS kann auch Ursache von epileptischen Anfällen sein oder diese fördern. Osmotische Schocks, die die Blut-Hirn-Schranke durchlässig machen, führten bei Patienten zu Anfällen. Ein GLUT1-Mangel in der BHS kann Epilepsie auslösen.2
8.5. Blut-Hirn-Schranke und Alzheimer
Auch bei Alzheimer bestehen etliche Hinweise auf einen Zusammenhang mit der Blut-Hirn-Schranke. Eingehend hierzu Profaci et al.2
8.6. Blut-Hirn-Schranke und Schlaganfall/Ischämie
Ein Schlaganfall geht mit zwei Phasen von Dysfunktion der BHS einher.2
innerhalb weniger Stunden bildet sich eine erste Verringerung der Durchlässigkeit der BHS (erste Phase).
Diese verringert sich bald wieder, tritt aber am folgenden Tag erneut auf (zweite Phase).
Während der ersten Phase nimmt die Transzytose unspezifischer Moleküle zu, gefolgt von strukturellen Veränderungen der Tight Junctions.
Ein Knockout von Leukozytenadhäsionsmolekülen oder Antikörper gegen Leukozytenadhäsionsmoleküle scheinen das Infarktvolumen zu verringern.2
Während der zweiten Phase stirbt die meisten Neuronen, die bei einem Schlaganfall zugrunde gehen.
Daneman R, Prat A (2015): The blood-brain barrier. Cold Spring Harb Perspect Biol. 2015 Jan 5;7(1):a020412. doi: 10.1101/cshperspect.a020412. PMID: 25561720; PMCID: PMC4292164. REVIEW ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥
Profaci CP, Munji RN, Pulido RS, Daneman R (2020): The blood-brain barrier in health and disease: Important unanswered questions. J Exp Med. 2020 Apr 6;217(4):e20190062. doi: 10.1084/jem.20190062. PMID: 32211826; PMCID: PMC7144528. REVIEW ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥
DocCheck Flexikon; Blut-Hirn-SchrankeDocCheck Flexikon; Blut-Hirn-Schranke german ↥
González-Mariscal L, Betanzos A, Nava P, Jaramillo BE (2003): Tight junction proteins. Prog Biophys Mol Biol. 2003 Jan;81(1):1-44. doi: 10.1016/s0079-6107(02)00037-8. PMID: 12475568. REVIEW ↥ ↥
Schwab, Matthias; Marx, Claudia; Zanger, Ulrich M.; Eichelbaum, Michel; Fischer-Bosch, Margarete (2002): Pharmakogenetik der Zytochrom-P-450-Enzyme: Bedeutung für Wirkungen und Nebenwirkungen von Medikamenten. Dtsch Arztebl 2002; 99(8): A-497 / B-400 / C-377 ↥
Tărlungeanu DC, Deliu E, Dotter CP, Kara M, Janiesch PC, Scalise M, Galluccio M, Tesulov M, Morelli E, Sonmez FM, Bilguvar K, Ohgaki R, Kanai Y, Johansen A, Esharif S, Ben-Omran T, Topcu M, Schlessinger A, Indiveri C, Duncan KE, Caglayan AO, Gunel M, Gleeson JG, Novarino G (2016): Impaired Amino Acid Transport at the Blood Brain Barrier Is a Cause of Autism Spectrum Disorder. Cell. 2016 Dec 1;167(6):1481-1494.e18. doi: 10.1016/j.cell.2016.11.013. PMID: 27912058; PMCID: PMC5554935. ↥ ↥ ↥ ↥
Montemitro C, Angebrandt A, Wang TY, Pettorruso M, Abulseoud OA (2021): Mechanistic insights into the efficacy of memantine in treating certain drug addictions. Prog Neuropsychopharmacol Biol Psychiatry. 2021 Dec 20;111:110409. doi: 10.1016/j.pnpbp.2021.110409. PMID: 34324921. REVIEW ↥
Medin T, Medin H, Hefte MB, Storm-Mathisen J, Bergersen LH (2019): Upregulation of the lactate transporter monocarboxylate transporter 1 at the blood-brain barrier in a rat model of attention-deficit/hyperactivity disorder suggests hyperactivity could be a form of self-treatment. Behav Brain Res. 2019 Mar 15;360:279-285. doi: 10.1016/j.bbr.2018.12.023. PMID: 30550949. ↥
Stöcker (2019): Adhäsionsmoleküle. Lexikon der Medizinischen Laboratoriumsdiagnostik. Springer. ↥
Lécuyer MA, Saint-Laurent O, Bourbonnière L, Larouche S, Larochelle C, Michel L, Charabati M, Abadier M, Zandee S, Haghayegh Jahromi N, Gowing E, Pittet C, Lyck R, Engelhardt B, Prat A (2017): Dual role of ALCAM in neuroinflammation and blood-brain barrier homeostasis. Proc Natl Acad Sci U S A. 2017 Jan 24;114(4):E524-E533. doi: 10.1073/pnas.1614336114. PMID: 28069965; PMCID: PMC5278491. ↥
Kim BJ, Hancock BM, Bermudez A, Del Cid N, Reyes E, van Sorge NM, Lauth X, Smurthwaite CA, Hilton BJ, Stotland A, Banerjee A, Buchanan J, Wolkowicz R, Traver D, Doran KS (2015): Bacterial induction of Snail1 contributes to blood-brain barrier disruption. J Clin Invest. 2015 Jun;125(6):2473-83. doi: 10.1172/JCI74159. PMID: 25961453; PMCID: PMC4497739. ↥
Prat A, Biernacki K, Wosik K, Antel JP (2001): Glial cell influence on the human blood-brain barrier. Glia. 2001 Nov;36(2):145-55. doi: 10.1002/glia.1104. PMID: 11596123. REVIEW ↥
Collignon A, Dion-Albert L, Ménard C, Coelho-Santos V (2024): Sex, hormones and cerebrovascular function: from development to disorder. Fluids Barriers CNS. 2024 Jan 4;21(1):2. doi: 10.1186/s12987-023-00496-3. PMID: 38178239; PMCID: PMC10768274. REVIEW ↥ ↥
Chi OZ, Barsoum S, Wen Y, Liu X, Weiss HR (2004): 17beta-estradiol prevents blood-brain barrier disruption induced by VEGF. Horm Metab Res. 2004 May;36(5):272-6. doi: 10.1055/s-2004-814478. PMID: 15156404. ↥
Mueller MD, Vigne JL, Minchenko A, Lebovic DI, Leitman DC, Taylor RN (2000): Regulation of vascular endothelial growth factor (VEGF) gene transcription by estrogen receptors alpha and beta. Proc Natl Acad Sci U S A. 2000 Sep 26;97(20):10972-7. doi: 10.1073/pnas.200377097. PMID: 10995484; PMCID: PMC27133. ↥
Masi A, Breen EJ, Alvares GA, Glozier N, Hickie IB, Hunt A, Hui J, Beilby J, Ravine D, Wray J, Whitehouse AJO, Guastella AJ (2017): Cytokine levels and associations with symptom severity in male and female children with autism spectrum disorder. Mol Autism. 2017 Dec 2;8:63. doi: 10.1186/s13229-017-0176-2. PMID: 29214007; PMCID: PMC5712192. ↥
Seidner G, Alvarez MG, Yeh JI, O’Driscoll KR, Klepper J, Stump TS, Wang D, Spinner NB, Birnbaum MJ, De Vivo DC (1998): GLUT-1 deficiency syndrome caused by haploinsufficiency of the blood-brain barrier hexose carrier. Nat Genet. 1998 Feb;18(2):188-91. doi: 10.1038/ng0298-188. PMID: 9462754. ↥
Klepper J, Voit T (2002): Facilitated glucose transporter protein type 1 (GLUT1) deficiency syndrome: impaired glucose transport into brain– a review. Eur J Pediatr. 2002 Jun;161(6):295-304. doi: 10.1007/s00431-002-0939-3. PMID: 12029447. REVIEW ↥
Vatine GD, Al-Ahmad A, Barriga BK, Svendsen S, Salim A, Garcia L, Garcia VJ, Ho R, Yucer N, Qian T, Lim RG, Wu J, Thompson LM, Spivia WR, Chen Z, Van Eyk J, Palecek SP, Refetoff S, Shusta EV, Svendsen CN (2017): Modeling Psychomotor Retardation using iPSCs from MCT8-Deficient Patients Indicates a Prominent Role for the Blood-Brain Barrier. Cell Stem Cell. 2017 Jun 1;20(6):831-843.e5. doi: 10.1016/j.stem.2017.04.002. PMID: 28526555; PMCID: PMC6659720. ↥
Argaw AT, Asp L, Zhang J, Navrazhina K, Pham T, Mariani JN, Mahase S, Dutta DJ, Seto J, Kramer EG, Ferrara N, Sofroniew MV, John GR (2012): Astrocyte-derived VEGF-A drives blood-brain barrier disruption in CNS inflammatory disease. J Clin Invest. 2012 Jul;122(7):2454-68. doi: 10.1172/JCI60842. PMID: 22653056; PMCID: PMC3386814. ↥
Chiaretti A, Genovese O, Aloe L, Antonelli A, Piastra M, Polidori G, Di Rocco C (2005): Interleukin 1beta and interleukin 6 relationship with paediatric head trauma severity and outcome. Childs Nerv Syst. 2005 Mar;21(3):185-93; discussion 194. doi: 10.1007/s00381-004-1032-1. PMID: 15455248. ↥
Joseph JK, Devu BK (2019): Prevalence of attention-deficit hyperactivity disorder in India: a systematic review and meta-analysis. Indian J Psychiatr Nurs. (2019) 16:118. doi: 10.4103/IOPN.IOPN_31_19, zitiert nach Kisku A, Nishad A, Agrawal S, Paliwal R, Datusalia AK, Gupta G, Singh SK, Dua K, Sulakhiya K (2024): Recent developments in intranasal drug delivery of nanomedicines for the treatment of neuropsychiatric disorders. Front Med (Lausanne). 2024 Sep 19;11:1463976. doi: 10.3389/fmed.2024.1463976. PMID: 39364023; PMCID: PMC11446881. REVIEW ↥
Ruocco LA, de Souza Silva MA, Topic B, Mattern C, Huston JP, Sadile AG (2009): Intranasal application of dopamine reduces activity and improves attention in Naples High Excitability rats that feature the mesocortical variant of ADHD. Eur Neuropsychopharmacol. 2009 Oct;19(10):693-701. doi: 10.1016/j.euroneuro.2009.02.005. PMID: 19328660. ↥
Fang Z, Shen G, Amin N, Lou C, Wang C, Fang M (2023): Effects of Neuroinflammation and Autophagy on the Structure of the Blood-Brain Barrier in ADHD Model. Neuroscience. 2023 Oct 15;530:17-25. doi: 10.1016/j.neuroscience.2023.08.025. PMID: 37625689. ↥
Johansson J, Landgren M, Fernell E, Vumma R, Åhlin A, Bjerkenstedt L, Venizelos N (2011): Altered tryptophan and alanine transport in fibroblasts from boys with attention-deficit/hyperactivity disorder (ADHD): an in vitro study. Behav Brain Funct. 2011 Sep 24;7:40. doi: 10.1186/1744-9081-7-40. PMID: 21942982; PMCID: PMC3191351. ↥
Rahman MT, Ghosh C, Hossain M, Linfield D, Rezaee F, Janigro D, Marchi N, van Boxel-Dezaire AHH (2018): IFN-γ, IL-17A, or zonulin rapidly increase the permeability of the blood-brain and small intestinal epithelial barriers: Relevance for neuro-inflammatory diseases. Biochem Biophys Res Commun. 2018 Dec 9;507(1-4):274-279. doi: 10.1016/j.bbrc.2018.11.021. PMID: 30449598. ↥
Özyurt, Öztürk, Appak, Arslan, Baran, Karakoyun, Tufan, Pekcanlar (2018): Increased zonulin is associated with hyperactivity and social dysfunctions in children with attention deficit hyperactivity disorder. Compr Psychiatry. 2018 Nov;87:138-142. doi: 10.1016/j.comppsych.2018.10.006. n = 81 ↥
Çakir A, Dogru H, Laloglu E (2023): Serum Occludin and Zonulin Levels in Children With Attention-Deficit/Hyperactivity Disorder and Healthy Controls. Indian Pediatr. 2023 Feb 15;60(1):137-141. PMID: 36786182. ↥
Aydoğan Avşar P, Işık Ü, Aktepe E, Kılıç F, Doğuç DK, Büyükbayram Hİ. Serum zonulin and claudin-5 levels in children with attention-deficit/hyperactivity disorder (2021): Int J Psychiatry Clin Pract. 2021 Mar;25(1):49-55. doi: 10.1080/13651501.2020.1801754. PMID: 32757874. ↥
Sayed SZ, Hassan ZO, Abdelraheem WM, Refaat RS, Abuelela IS (2024): Is there a link between peripheral inflammation and blood brain barrier integrity in children with attention-deficit/hyperactivity disorder? A case-control study. BMC Pediatr. 2024 Nov 26;24(1):769. doi: 10.1186/s12887-024-05254-4. PMID: 39592970; PMCID: PMC11590277. ↥
Asbjornsdottir B, Snorradottir H, Andresdottir E, Fasano A, Lauth B, Gudmundsson LS, Gottfredsson M, Halldorsson TI, Birgisdottir BE (2020): Zonulin-Dependent Intestinal Permeability in Children Diagnosed with Mental Disorders: A Systematic Review and Meta-Analysis. Nutrients. 2020 Jul 3;12(7):1982. doi: 10.3390/nu12071982. PMID: 32635367; PMCID: PMC7399941. METASTUDY ↥
Lee SY, Li SC, Yang CY, Kuo HC, Chou WJ, Wang LJ (2023): Gut Leakage Markers and Cognitive Functions in Patients with Attention-Deficit/Hyperactivity Disorder. Children (Basel). 2023 Mar 5;10(3):513. doi: 10.3390/children10030513. PMID: 36980071; PMCID: PMC10047799. ↥ ↥
Ling X, Linglong P, Weixia D, Hong W (2016): Protective Effects of Bifidobacterium on Intestinal Barrier Function in LPS-Induced Enterocyte Barrier Injury of Caco-2 Monolayers and in a Rat NEC Model. PLoS One. 2016 Aug 23;11(8):e0161635. doi: 10.1371/journal.pone.0161635. PMID: 27551722; PMCID: PMC4995054. ↥
Khailova L, Dvorak K, Arganbright KM, Halpern MD, Kinouchi T, Yajima M, Dvorak B (2009): Bifidobacterium bifidum improves intestinal integrity in a rat model of necrotizing enterocolitis. Am J Physiol Gastrointest Liver Physiol. 2009 Nov;297(5):G940-9. doi: 10.1152/ajpgi.00141.2009. PMID: 20501441; PMCID: PMC2777452. ↥
Guttmann CR, Rousset M, Roch JA, Hannoun S, Durand-Dubief F, Belaroussi B, Cavallari M, Rabilloud M, Sappey-Marinier D, Vukusic S, Cotton F (2016): Multiple sclerosis lesion formation and early evolution revisited: A weekly high-resolution magnetic resonance imaging study. Mult Scler. 2016 May;22(6):761-9. doi: 10.1177/1352458515600247. PMID: 26362901. ↥
Miller DH, Khan OA, Sheremata WA, Blumhardt LD, Rice GP, Libonati MA, Willmer-Hulme AJ, Dalton CM, Miszkiel KA, O’Connor PW; International Natalizumab Multiple Sclerosis Trial Group (2003): A controlled trial of natalizumab for relapsing multiple sclerosis. N Engl J Med. 2003 Jan 2;348(1):15-23. doi: 10.1056/NEJMoa020696. PMID: 12510038. ↥
